For Patients
TRAJTIMI DHE MENAXHIMI I SKLEROZËS MULTIPLE
Trajtimi zakonisht fokusohet në përshpejtimin e rikuperimit nga sulmet (relapset), reduktimin e relapseve të reja radiologjike dhe klinike, ngadalësimin e progresit të sëmundjes dhe menaxhimin e simptomave të MS-së. Disa njerëz kanë simptoma kaq të buta sa që nuk nevojitet trajtim.
TRAJTIMI I RELAPSEVE
- Kortikosteroidet, si prednizoni oral dhe metilprednisoloni intravenoz, përshkruhen për ta reduktuar inflamacionin. Efektet anësore mund të përfshijnë pagjumësinë, rritjen e shtypjes së gjakut, rritjen e nivelit të glukozës në gjak, ndryshimet e humorit dhe mbajtjen e lëngjeve.
- Plazmafereza (shkëmbimi i plazmës) - pjesa e lëngshme e një pjese të gjakut (plazma) hiqet dhe ndahet nga qelizat e gjakut. Qelizat e gjakut më pas përzihen me një tretësirë proteinike (albuminë) dhe futen përsëri në trup. Plazmafereza mund të përdoret nëse simptomat janë të reja, të rënda dhe nuk janë tërhequr mjaftueshëm me steroide.
TERAPIA IMUNOMODULATORE
Ekzistojnë disa terapi modifikuese të sëmundjes (DMT) për RRMS. Disa nga këto DMT mund të jenë të dobishme për SPMS dhe aktualisht një është në dispozicion për formën PPMS.
Pjesa më e madhe e përgjigjes imunitare e lidhur me MS-në ndodh në fazat e hershme të sëmundjes. Trajtimi agresiv me këto medikamente sa më shpejt që të jetë e mundur mund ta ulë shkallën e relapseve, ta ngadalësojë formimin e lezioneve të reja dhe potencialisht të zvogëlojë rrezikun e atrofisë së trurit dhe akumulimin e paaftësisë.
Zgjedhja e terapisë së duhur për ju do të varet nga shqyrtimi i kujdesshëm i shumë faktorëve, duke përfshirë kohëzgjatjen dhe ashpërsinë e sëmundjes, efektivitetin e trajtimeve të mëparshme të MS-së, çështje të tjera shëndetësore, koston dhe statusin e lindjes së fëmijëve. NË REPUBLIKËN E KOSOVËS, NUK JANË TË GJITHA E BARNAT IMUNOMODULATORE TË PËRFSHIRA NË LISTËN ESENCIALE TË MINISTRISË SË SHËNDETËSISË (MSH). ATO BARNA QË SIGUROHEN NGA MSH-JA SIGUROHEN NË DOZA TË KUFIZUARA DHE TË PAMJAFTUESHME NË MËNYRË QË SECILI PACIENT TA MERR CILINDO LLOJ TERAPISË. PRANDAJ, KOLEGJIUMI PROFESIONAL I KLINIKËS SË NEUROLOGJISË KA VENDOSUR KRITERE KLINIKE DHE RADIOLOGJIKE, SI EDHE KRITERE QË MARRIN PARASYSH DISPONUESHMËRINË E BARIT NGA MSH-JA, GJATË PROCESIT TË VENDOSJES SË TERAPISË PËR SECILIN PACIENT.
Opsionet e trajtimit për RMS përfshijnë medikamente injektuese, orale dhe me infuzion.
Trajtimet me injeksion nënlëkurë përfshijnë:
- Interferonet. Këto barna kanë qenë medikamentet më të përshkruara për trajtimin e MS-së. Ato funksionojnë duke e zvogëluar inflamacionin. Ato injektohen nën lëkurë dhe mund të zvogëlojnë shpeshtësinë dhe ashpërsinë e relapseve. Efektet anësore të interferoneve mund të përfshijnë simptoma të ngjashme me gripin dhe reaksione në vendin e injektimit. Do të ketë nevojë për analiza gjaku për t’i monitoruar enzimat e mëlçisë, sepse dëmtimi i mëlçisë është një efekt anësor i mundshëm i përdorimit të interferonit. Njerëzit që marrin interferone mund të zhvillojnë antitrupa neutralizues që mund të zvogëlojnë efektivitetin e ilaçit.
- Glatiramer acetati (Copaxone). Ky medikament mund të ndihmojë në ndaljen e sulmit të sistemit imunitar ndaj mielinës. Injektohet nën lëkurë. Efektet anësore mund të përfshijnë reaksione të lëkurës në vendin e injektimit.
- Ofatumumabi (Kesimpta) synon qelizat qe ë dëmtojnë sistemin nervor. Këto qeliza quhen limfocite B. Ofatumumabi jepet me një injeksion nën lëkurë dhe mund të zvogëlojë numrin e lezioneve në tru dhe përkeqësimin e simptomave. Efektet anësore të mundshme janë infeksionet, reaksionet lokale ndaj injeksionit dhe kokëdhimbje.
Trajtimet orale përfshijnë:
- Teriflunomidi (Aubagio). Ky medikament oral merret një herë në ditë dhe mund të zvogëlojë shkallën e relapseve. Teriflunomidi mund të shkaktojë dëmtim të mëlçisë, rënie të flokëve dhe efekte të tjera anësore. Ky medikament shoqërohet me defekte të lindjes kur merret si nga burrat ashtu edhe nga gratë. Prandaj, përdoret kontracepsioni gjatë marrjes së këtij ilaçi dhe deri në dy vjet më pas. Çiftet që planifikojnë shtatzëni duhet të flasin me mjekun për mënyrat për të shpejtuar eliminimin e barit nga trupi. Ky medikament kërkon monitorim të rregullt të testeve të gjakut.
- Dimetil fumarati (Tecfidera). Ky medikament oral merret dy herë në ditë dhe mund t’i reduktojë relapset. Efektet anësore mund të përfshijnë skuqje, diarre, nauze dhe ulje të numrit të qelizave të bardha të gjakut. Ky medikament kërkon monitorim të rregullt të testeve të gjakut.
- Fingolimodi (Gilenya). Ky medikament oral merret një herë në ditë dhe redukton shkallën e relapseve. Duhet monitorimi i rrahjeve të zemrës dhe presionit të gjakut për gjashtë orë pas dozës së parë, sepse rrahjet e zemrës mund të ngadalësohen. Efekte të tjera anësore përfshijnë infeksione të rralla serioze, dhimbje koke, presion të lartë të gjakut dhe shikim të paqartë.
- Siponimodi (Mayzent). Hulumtimet tregojnë se ky medikament oral një herë në ditë mund të zvogëlojë shkallën e relapseve dhe të ndihmojë në ngadalësimin e zhvillimit të MS-së. Është miratuar gjithashtu për SPMS. Efektet anësore të mundshme përfshijnë infeksionet virale, problemet e mëlçisë dhe rënien e numrit të qelizave të bardha të gjakut. Efekte të tjera të mundshme anësore përfshijnë ndryshime në rrahjet e zemrës, dhimbje koke dhe probleme me shikimin. Siponimodi është i dëmshëm për një fetus në zhvillim, kështu që gratë që mund të mbeten shtatzënë duhet të përdorin kontracepsion kur marrin këtë terapi dhe për 10 ditë pas ndërprerjes së terapisë. Disa mund të kenë nevojë të monitorojnë rrahjet e zemrës dhe presionin e gjakut për gjashtë orë pas dozës së parë. Ky medikament kërkon monitorim të rregullt të testeve të gjakut.
- Ozanimodi (Zeposia). Ky medikament oral e ul shkallën e relapseve të sklerozës multiple dhe jepet një herë në ditë. Efektet anësore të mundshme janë presioni i lartë i gjakut, infeksionet dhe inflamacioni i mëlçisë.
- Kladribini (Mavenclad). Ky medikament në përgjithësi përshkruhet si një trajtim i linjës së dytë për personat me RRMS dhe SPMS. Ai jepet në dy kurse trajtimi, të shpërndara në një periudhë dy javore, gjatë dy viteve. Efektet anësore përfshijnë infeksione të rrugëve të sipërme të frymëmarrjes, dhimbje koke, tumore, infeksione serioze dhe ulje të niveleve të qelizave të bardha të gjakut. Njerëzit që kanë infeksione kronike aktive ose kancer nuk duhet ta marrin këtë medikament, as gratë që janë shtatzëna ose ushqejnë me gji. Burrat dhe gratë duhet të përdorin kontracepsion gjatë marrjes së këtij medikamenti dhe për gjashtë muajt në vijim. Mund të ketë nevojë për monitorim me analiza gjaku gjatë marrjes së cladribine.
Terapitë me Infuzion
- Okrelizumabi (Ocrevus). Redukton numrin e relapseve dhe ulë rrezikun e shfaqjes së paaftësive në pacientët me RRMS. Gjithashtu e ngadalëson progresin e sëmundjes te pacientët me PPMS. Është një antitrup monoklonal i humanizuar, i vetmi i aprovuar nga autoritetet amerikane dhe evropiane për trajtim të RRMS dhe PPMS. Studimet klinike kanë treguar që redukton numrin e relapseve dhe ngadalëson përkesësimin e paaftësive në të dy format e sëmundjes. Okrelizumabi administrohet si infuzion intravenoz nga një profesionist shëndetësor. Mund të shfaqen reaksione të shoqëruara me infuzionin si irritim në vendin e injektimit, mundim, temperaturë, ulje e shtypjes së gjakut. Disa njerëz mund të mos kenë mundësi të trejtohetn me okrelizumab, duke përfshirë ata që kane infeksion me hepatit B. Okrelizumabi gjithashtu mund të rrisë gjasat për shfaqje te infeksioneve dhe disa llojeve të kancerit, veçanërisht kancerin e gjirit.
- Natalizumabi (Tysabri). Është antitrup monoklonal i cili ka treguar se mund të ulë numrin e relapseve dhe të ngadalësojë rrezikun e paaftësisë (invaliditetit). Ky medikament është i dizajnuar të bllokojë lëvizjen e qelizave imunitare potencialisht të dëmshme nga qarkullimi i gjakut për në tru dhe palcë kurrizore. Mund të konsiderohet si terapi e linjës së parë te disa persona me MS shumë të ashpër, dhe si terapi e linjës së dytë te të tjerët. Ky medikament rritë mundësinë e shfaqjes së një infeksioni potencial serioz viral të trurit që quhet leukoencefalopati multifokale progresive (PML) në personat që janë pozitivë për antitrupa të agjentit shkaktar, virusit JC. Personat që nuk e kanë këtë antitrup kanë rrezik tejet të ulët të shfaqjes së PML-së.
- Alemtuzumabi (Lemtrada). Është antitrup monoklonal që e zvogëlon numrin vjetor të relapseve dhe demonstron benefit edhe në MRI. Ky bar ndihmon në reduktimin e numrit të relapseve duke e targetuar një protein në sipërfaqe të qelizave të imunitetit dhe duke pakësuar qelizat e bardha të gjakut. Ky efekt mund të zvogëlojë potencialin e dëmtimit të nervave të shkaktuar nga qelizat e bardha të gjakut. Por gjithashtu rritë numrin e infeksioneve dhe çrregullimeve autoimune, duke përfshirë sëmundjet autoimune të tiroidesë dhe sëmundje të rrallë të veshkëve të ndërmjetësuar nga imuniteti. Trajtimi me alemtuzumab përfshinë pesë ditë me rradhë të infuzioneve të barit përcjellur me tri ditë tjera të infuzioneve, një vit më vonë. Reaksionet e lidhura me infuzionin janë të shpeshta me alemtuzumab. Pacientët e trajtuar me alemtuzumab duhet të regjistrohen në një program të veçantë të monitorimit të barit. Alemtuzumabi zakonisht rekomandohet te pacientët me formë agresive të MS-së si linjë e pare e trajtimit, apo si linjë e dytë te pacientët të cilët nuk kanë pasur sukses me linjë të mëhershme të trajtimit.
ZHVILLIMET E FUNDIT DHE TERAPITË NË PERSPEKTIVË
Bruton’s tyrosine kinase (BTK) inhibitorët janë duke u studiuar në RRMS dhe SPMS. Mënyrën e veprimit e kanë duke e moduluar limfocitet B, të cilat janë qeliza imunitare në sistemin nervor qendror.
Transplantimi i Palcës Kockore shkatërron sistemin imunitar të personit me MS dhe e zëvendëson atë me qeliza amë të transplantuara të shëndosha. Shkencëtarët janë ende duke hulumtuar nëse kjo terapi mund të reduktojë inflamacionin në personat me MS dhe të ndihmojë në një “reset” të sistemit imunitar. Efektet e mundshme anësore janë temperatura dhe infeksionet.
Hulumtuesit po mësojnë më shumë rreth asaj se sa efektive janë terapitë aktuale modifikuese të sëmundjes në reduktimin e lezioneve të sklerozës multiple në tru. Studime të reja do të determinojnë nëse trajtimi mund të shtyjë paaftësinë e shkaktuar nga sëmundja.
Për PPMS, okrelizumabi është e vetmja terapi modifikuese e sëmundjes e aprovuar nga FDA dhe EMA. Ata që marrin këtë trajtim kanë më pak gjasa të pësojnë zhvillim të sëmundjes sesa ata që nuk trajtohen.
Për PSMS, disa mund të marrin në konsideratë përdorimin e terapive modifikuese të sëmundjes të miratuara nga FDA, të tilla si ozanimod, siponimod dhe kladribin, të cilat potencialisht mund të ngadalësojnë progresin e sëmundjes.
TRAJTIMI SIMPTOMATIK
Terapia fizikale mund të rrisë forcën e muskujve dhe të lehtësojë disa nga simptomat e MS-së.
Një fizioterapist mund t'i mësojë ushtrimet për zgjatje dhe forcim të muskujve dhe të tregojë se si të përdoren pajisje të caktuara për ta bërë më të lehtë kryerjen e punëve të përditshme.
Relaksuesit e muskujve. Mund të ketë ngurtësi dhe spazma të dhimbshme ose të pakontrollueshme të muskujve, vecanërisht në këmbë. Relaksuesit e muskujve, si baklofeni (Lioresal), tizanidini (Zanaflex) dhe ciklobenzaprini mund të ndihmojnë. Trajtimi me onabotulinumtoksinë A është një mundësi tjetër për spasticitet.
Medikamente për ta reduktuar lodhjen. Amantadini (PK-Merz), modafinili (Provigil) dhe metilfenidati (Ritalin) janë efikase për të reduktuar lodhjen e lidhur me MS-në. Megjithatë, një studim i kohëve të fundit nuk zbuloi se amantadini, modafinili ose tilfenidati janë superiorë ndaj placebos në përmirësimin e lodhjes së lidhur me MS-në dhe shkaktuan efekte negative më të shpeshta. Disa barna për trajtimin e depresionit, duke i përfshirë Inhibitorët selektivë të rimarrjes së serotoninës (SSRI), mund të rekomandohen.
Medikamente për të rritur shpejtësinë e ecjes. Dalfampridini (Fampyra) mund të ndihmojë në rritjen e shpejtësisë së ecjes tek disa njerëz. Efektet anësore të përdorimit të tyre janë infeksionet e traktit urinar, vertigoja, pagjumësia dhe kokëdhimbja. Personat me histori konvulsionesh ose me mosfunksionim të veshkave nuk duhet të marrin këtë mjekim.
Medikamente të tjera. Mund të përshkruhen gjithashtu medikamente për depresionin, dhimbjen, mosfunksionimin seksual, pagjumësinë dhe problemet e kontrollit të fshikëzës ose zorrëve që lidhen me MS-në.
STILI I JETËS DHE PAJISJET NË SHTËPI
Për të ndihmuar në lehtësimin e shenjave dhe simptomave të MS-së, përpiquni të:
Pushoni shumë. Kontrolloni shprehitë tuaja të gjumit për t'u siguruar që po bëni gjumin më të mirë të mundshëm. Për t'u siguruar që po flini mjaftueshëm, mund t'ju duhet të vlerësoheni - dhe ndoshta të trajtoheni - për çrregullime të gjumit sikur që është apnea obstruktive e gjumit.
Ushtrimet. Nëse keni MS të lehtë deri të moderuar, ushtrimet e rregullta mund të ndihmojnë në përmirësimin e forcës, tonusit të muskujve, ekuilibrit dhe koordinimit. Noti ose ushtrime të tjera në ujë janë opsione të mira nëse keni intolerancë ndaj nxehtësisë. Llojet e tjera të ushtrimeve të lehta deri të moderuara të rekomanduara për njerëzit me MS përfshijnë ecjen, shtrirjen, gjimnastikën me impakt të ulët, biçikletën stacionare, joga dhe tai chi.
Kujdes nga temperaturat e larta. Simptomat e MS-së mund të përkeqësohen kur temperatura e trupit rritet. Shmangia e ekspozimit ndaj nxehtësisë dhe përdorimi i pajisjeve të tilla si shalli ose jeleku ftohës mund të jenë të dobishme.
Dieta e ekuilibruar. Meqenëse ka pak prova për të mbështetur një dietë të caktuar, ekspertët rekomandojnë një dietë përgjithësisht të shëndetshme. Disa studime sugjerojnë se vitamina D mund të ketë përfitime të mundshme për njerëzit me MS.
Pakësoni stresin. Stresi mund të shkaktojë ose përkeqësojë shenjat dhe simptomat tuaja. Joga, tai chi, masazhi, meditimi ose frymëmarrja e thellë mund të ndihmojnë.
MJEKËSIA ALTERNATIVE
Shumë njerëz me MS përdorin një sërë trajtimesh alternative ose plotësuese ose të dyja për të ndihmuar në menaxhimin e simptomave të tyre, të tilla si lodhja dhe dhimbjet e muskujve.
Aktivitete të tilla si stërvitja, meditimi, joga, masazhi, ngrënia e një diete më të shëndetshme, akupunktura dhe teknikat e relaksimit mund të ndihmojnë në rritjen e mirëqenies së përgjithshme mendore dhe fizike te pacientët me MS.
Sipas udhëzimeve nga Akademia Amerikane e Neurologjisë (AAN), hulumtimi tregon fuqishëm se ekstrakti oral i kanabisit (OCE) mund të përmirësojë simptomat e spazticitetit dhe dhimbjes së muskujve. Ka mungesë të provave që kanabisi në çdo formë tjetër është efektiv në menaxhimin e simptomave të tjera të MS-së.
Marrja ditore e vitaminës D3 prej 2000 deri në 5000 njësi ndërkombëtare në ditë rekomandohet te ata me MS. Lidhja midis vitaminës D dhe MS-së mbështetet nga lidhja me ekspozimin ndaj dritës së diellit dhe rrezikun e MS-së.
BALLAFAQIMI ME MS DHE MBËSHTETJA
Të jetosh me ndonjë sëmundje kronike mund të jetë e vështirë. Për të menaxhuar stresin e të jetuarit me MS, merrni parasysh këto sugjerime:
- Mbani aktivitetet normale të përditshme sa më mirë që mundeni.
- Qëndroni të lidhur me miqtë dhe familjen.
- Vazhdoni të ndiqni hobi që ju pëlqen dhe jeni në gjendje t'i bëni.
- Kontaktoni një grup mbështetës, për veten tuaj ose për anëtarët e familjes.
- Diskutoni ndjenjat dhe shqetësimet tuaja për të jetuar me MS me mjekun tuaj.
PËRGATITJA PËR TERMININ ME SPECIALISTIN
Çfarë mund të bëni
- Shkruani simptomat tuaja, përfshirë ato që mund të duken të palidhura me arsyen pse keni caktuar takimin.
- Bëni një listë të të gjitha ilaçeve, vitaminave dhe suplementeve.
- Sillni çdo shënim klinik, skanim, rezultat të testit laboratorik ose informacion tjetër nga mjeku familjar te neurologu juaj.
- Shkruani informacionet tuaja kryesore mjekësore, duke përfshirë problemet tjera shëndetësore që mund të keni.
- Shkruani informacionet kryesore personale, duke përfshirë çdo ndryshim ose stres të fundit në jetën tuaj.
- Shkruani pyetjet për të pyetur mjekun tuaj.
- Kërkojini një të afërmi ose miku që t'ju shoqërojë, për t'ju ndihmuar të mbani mend atë që thotë mjeku.
ÇFARË TË PRISNI NGA MJEKU
Mjeku juaj ka të ngjarë t'ju bëjë pyetje. Të qenit gati për t'iu përgjigjur atyre mund të rezervojë kohë për të shqyrtuar pikat ku dëshironi të shpenzoni më shumë kohë. Ju mund të pyeteni:
- Kur keni filluar të përjetoni simptoma?
- A kanë qenë simptomat tuaja të vazhdueshme apo të rastësishme?
- Sa të rënda janë simptomat tuaja?
- Çfarë, nëse ka ndonjë gjë, duket se përmirëson simptomat tuaja?
- Çfarë, nëse ka ndonjë gjë, duket se i përkeqëson simptomat tuaja?
- A ka dikush në familjen tuaj sklerozë multiple?
PYETJET QË DUHET T’I BËHEN MJEKUT
- Cili është shkaku më i mundshëm i simptomave të mia?
- Çfarë lloj testesh më duhen? A kërkojnë ndonjë përgatitje të veçantë?
- A ka të ngjarë gjendja ime e përkohshme apo kronike?
- A do të përparojë gjendja ime?
- Cilat trajtime janë në dispozicion?
- Unë kam këto probleme tjera shëndetësore. Si mund t'i menaxhoj më së miri së bashku?
Përveç pyetjeve që keni përgatitur t'i bëni mjekut tuaj, mos hezitoni të bëni pyetje të tjera gjatë takimit tuaj.
SKLEROZA MULTIPLE
Skleroza Multiple (MS) është një sëmundje e sistemit nervor qendror (trurit dhe palcës kurrizore) e cila mund të shkaktojë paaftësi/invaliditet. Në MS, sistemi imunitar sulmon mbështjellësin mbrojtës të fijeve nervore (mielinën) gjë që shkakton probleme komunikimi në mes trurit dhe pjesës tjetër të trupit. Përfundimisht, sëmundja mund të shkaktojë çrregullim të funksionit apo edhe dëmtim të përhershëm në sistemin nervor. Shenjat dhe simptomat e MS-së ndryshojnë nga pacienti në pacient dhe varen nga vendi dhe ashpërsia e dëmtimit të fijeve nervore në sistemin nervor qendror. Disa njerëz me formë më agresive të MS-së mund të humbasin aftësinë për të ecur në mënyrë të pavarur ose mund të mos jenë në gjendje për të ecur fare. Individë të tjerë mund të përjetojnë periudha të gjata remisioni pa simptoma të reja, varësisht nga lloji i MS-së që kanë. Aktualisht skleroza multiple është sëmundje e pashërueshme, megjithatë ka terapi që me sukses trajton relapset (sulmet), terapi modifikuese të sëmundjes dhe terapi për menaxhimin e simptomave.
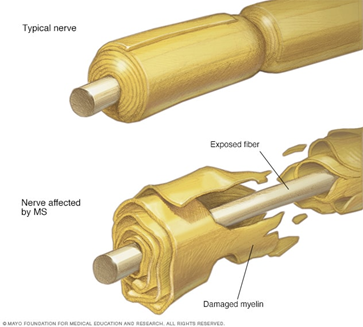
Shenjat dhe simptomat e sklerozës multiple mund të ndryshojnë shumë nga personi në person dhe gjatë rrjedhës së sëmundjes mund të manifestohen simptoma të llojllojshme. Simptomat e zakonshme përfshijnë:
- Mpirja ose dobësimi në një ose më shumë gjymtyrë që zakonisht ndodh në njërën anë të trupit në të njëjtën kohë
- Ndjesia e shpimit të gjilpërave
- Ndjesitë e goditjes elektrike që ndodhin me lëvizje të caktuara të qafës, veçanërisht përkuljen e qafës përpara (shenja Lhermitte)
- Mungesa e koordinimit
- Ecja e paqëndrueshme ose paaftësi për të ecur
- Humbja e pjesshme ose e plotë e shikimit, zakonisht në një sy në një kohë, shpesh me dhimbje gjatë lëvizjes së syrit
- Shikimi i dyfishtë i zgjatur
- Turbullimi i shikimit
- Marramendja
- Probleme me funksionin seksual, funksion të zorrëve dhe të fshikëzës urinare
- Plogështia
- Të folurit i paqartë
- Problemet njohëse
- Çrregullimet e humorit
ZHVILLIMI I SËMUNDJES
Shumica e njerëzve me MS kanë një ecuri të sëmundjes me përkeqësime dhe përmirësime (relapsing remitting) – RRMS. Ata përjetojnë periudha simptomash të reja ose relapse që zhvillohen gjatë disa ditëve ose javëve dhe zakonisht përmirësohen pjesërisht ose plotësisht. Këto relapse pasohen nga periudha të qetësimit apo remisionit të sëmundjes që mund të zgjasin me muaj apo edhe vite.
Rritjet e vogla të temperaturës së trupit mund të përkeqësojnë përkohësisht shenjat dhe simptomat e MS-së. Këto nuk konsiderohen rikthime të vërteta të sëmundjes, por pseudorelapse.
Rreth 20% deri në 40% e pacientëve me RRMS, 10-20 vjet nga fillimi i simptomave mund të zhvillojnë përfundimisht një progresion të qëndrueshëm të sëmundjes, me ose pa periudha remisioni. Kjo njihet si MS progresive sekondare (SPMS).
Përkeqësimi i simptomave zakonisht përfshin problemet me lëvizshmërinë dhe ecjen. Shkalla e përparimit të sëmundjes ndryshon shumë tek njerëzit me SPMS. Disa njerëz me MS përjetojnë një fillim gradual dhe përparim të qëndrueshëm të shenjave dhe simptomave pa ndonjë qetësim apo remision, i njohur si MS progresive primare (PPMS).
SHKAKTARËT
Shkaktarët e sklerozës multiple janë të panjohura. Konsiderohet një sëmundje e ndërmjetësuar nga imuniteti, në të cilën sistemi imunitar i trupit sulmon indet e veta. Në rastin e MS-së, ky çrregullim i sistemit imunitar dëmton substancën proteinike-yndyrore që i mbulon dhe i mbron fibrat nervore në tru dhe palcën kurrizore (mielinën). Mielina mund të krahasohet me veshjen izoluese në telat elektrikë. Kur mielina dëmtohet dhe fija nervore ekspozohet, sinjalet që udhëtojnë përgjatë asaj fijeje nervore mund të ngadalësohen ose bllokohen. Nuk është e qartë pse MS-ja zhvillohet te disa njerëz dhe jo tek të tjerët. Duket se përgjegjës janë kombinim i faktorëve gjenetikë dhe mjedisorë.
FAKTORËT E RREZIKUT
Këta faktorë mund të rrisin rrezikun e zhvillimit të sklerozës multiple:
- Mosha. MS-ja mund të ndodhë në çdo moshë, por fillimi zakonisht ndodh rreth moshës 20 deri 40 vjeç. Megjithatë, mund të preken edhe fëmijet dhe të moshuarit.
- Gjinia. Gratë kanë 2-3 herë me shumë gjasa të preken nga MS-ja se meshkujt.
- Historia familjare. Rreziku për të zhvilluar MS rritet nëse njëri nga prindërit ose vëllezërit apo motrat vuan nga MS-ja.
- Infeksione të caktuara. Një shumëllojshmëri virusesh janë lidhur me MS-në, duke përfshirë virusin Epstein-Barr (EBV), i cili shkakton mononukleozën infektive.
- Raca. Njerëzit e bardhë, veçanërisht ata me origjinë nga Evropa Veriore, janë më të rrezikuar të zhvillojnë MS. Njerëzit me origjinë aziatike, afrikane ose vendase amerikane janë më pak të rrezikuar. Një studim i kohëve të fundit sugjeron se numri i të rinjve zezakë dhe hispanikë me sklerozë multiple mund të jetë më i madh sesa mendohej më parë.
- Klima. MS-ja është shumë më e zakonshme në vendet me klimë të butë, duke përfshirë Kanadanë, Shtetet e Bashkuara, Zelandën e Re, Australinë juglindore dhe Evropën. Muaji i lindjes mund të ndikojë gjithashtu në shanset e zhvillimit të MS-së, pasi ekspozimi në diell kur një nënë është shtatzënë duket se ul zhvillimin e mëvonshëm të MS-së tek këta fëmijë.
- Vitamina D. Nivelet e ulëta të vitaminës D dhe ekspozimi i ulët ndaj dritës së diellit lidhet me një rrezik më të madh të shfaqjes së MS-së.
- Gjenet. Një gjen në kromozomin 6p21 është gjetur të jetë i lidhur me MS-në.
- Obeziteti. Një lidhje me obezitetin dhe MS-në është gjetur tek gratë. Kjo është veçanërisht e vërtetë për obezitetin e grave të shfaqur në fëmijëri dhe adoleshencë.
- Disa sëmundje autoimune. Është një rrezik pak më i lartë për të zhvilluar MS-në nëse ka çrregullime të tjera autoimmune, si sëmundjet e tiroidesë, anemia pernicioze, psoriaza, diabeti i tipit 1 ose sëmundja inflamatore e zorrëve.
- Pirja e duhanit. Duhanpirësit që përjetojnë një simptomë fillestare që mund të sinjalizojë MS-në kanë më shumë gjasa se joduhanpirësit të zhvillojnë një ngjarje të dytë që konfirmon MS-në me relapse dhe remisione.
KOMPLIKIMET
- Personat me sklerozë multiple mund të zhvillojnë gjithashtu:
- Ngurtësi ose spazma të muskujve
- Dobësi ose paralizë të rëndë, zakonisht në këmbë
- Probleme me fshikëzën urinare, zorrët ose funksionin seksual
- Probleme njohëse, si harresë ose vështirësi në gjetjen e fjalëve
- Probleme të humorit, si depresion, ankth ose ndryshime të humorit
- Konvulsione, edhe pse shumë rrallë
DIAGNOSTIKIMI
Nuk ka teste specifike për MS. Diagnoza e sklerozës multiple shpesh mbështetet në përjashtimin e sëmundjeve tjera që mund të kenë shenja dhe simptoma të ngjashme. Mjeku do të fillojë me historinë tuaj mjekësore dhe ekzaminimin e plotë.
Më pas ai mund të rekomandojë:
- Testet e gjakut, për të ndihmuar në përjashtimin e sëmundjeve të tjera simptomat e të cilave ngjajnë me MS-në. Testet për të kontrolluar për biomarkerë specifikë të lidhur me MS-në janë aktualisht në zhvillim dhe mund të ndihmojnë gjithashtu në diagnostikimin e sëmundjes.
- Punksionin lumbal, në të cilin një sasi e vogël e lëngut trunoshpinor (LTSH) merret nga kanali spinal për analiza laboratorike. Kjo mund të tregojë anomalitë në biomarkerët që lidhen me MS-në. Punksioni lumbal mund të ndihmojë gjithashtu në përjashtimin e infeksioneve dhe sëmundjeve të tjera me simptoma si të MS-së. Një test i ri i substancës (për “kappa free light chains”) mund të jetë më i shpejtë dhe më pak i kushtueshëm se testet e mëparshme të lëngut trunoshpinor për sklerozën multiple.

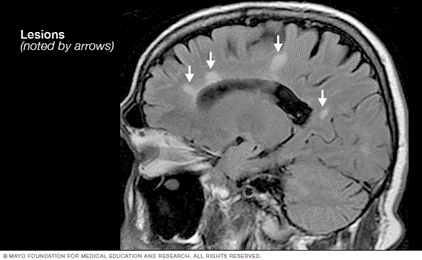
- MRI (Rezonanca Magnetike), e cila mund të zbulojë zona të lezioneve në tru dhe palcën kurrizore. Mund të jepet një injeksion intravenoz që përmban një substancë kontrasti për të treguar nëse lezionet janë apo jo në fazën aktive.
- Testet e Potencialeve të Evokuara regjistrojnë sinjalet elektrike të prodhuara nga sistemi nervor në përgjigje të stimujve. Një test potencial i evokuar mund të përdorë stimuj vizualë ose stimuj elektrikë.
Në shumicën e njerëzve me RRMS, diagnoza është e drejtpërdrejtë dhe e bazuar në një numër simptomash në përputhje me sëmundjen dhe të konfirmuar nga skanimet e imazhit të trurit, të tilla si MRI.
Diagnostikimi i MS-së mund të jetë më i vështirë te njerëzit me simptoma të pazakonta ose sëmundje progresive. Në këto raste, mund të nevojiten testime të mëtejshme me analiza të lëngut trunoshpinor, potencialet e evokuara dhe imazheritë shtesë.
Përgatiti: Dr. Diana Mejzinolli
Redaktoi: Ass. Dr. Blerim Myftiu
HEMATOMA EPIDURALE
Hematoma epidurale (HED) është grumbullimi i gjakut midis kafkës dhe dura mater, membranës së trashë që e mbulon trurin. Truri ka tre mbështjellës (të quajtura meningje) që shtrihen midis kafkës dhe indit të trurit. Qëllimi i meningjeve është të mbulojnë dhe mbrojnë trurin dhe palcën kurrizore. Nëse ndodh një hematomë epidurale, ka të ngjarë të ketë pasur një çarje në një enë gjaku, zakonisht në një arterie, por ndonjëherë në venë, dhe gjaku të rrjedh në dura mater. Gjaku që rrjedh ushtron presion mbi trurin dhe mund të shkaktojë më shumë dëmtime të tij. Nëse gjakderdhja ndodh brenda shtyllës kurrizore, quhet HED kurrizore.
Hematoma epidurale mund të jetë një gjendje kërcënuese për jetën. Zakonisht kërkon trajtim të menjëhershëm ose mund të shkaktojë dëmtim të trurit ose edhe vdekje deri në 15% të rasteve nëse nuk trajtohet. Zakonisht janë më të shpeshta tek të rinjtë dhe veçanërisht tek ata që kanë përjetuar frakturë të kafkës. Lëndimet e kokës ndodhin zakonisht gjatë aktiviteteve atletike (snowboarding, skateboarding, biçikleta) dhe nga aksidentet me makinë ose motoçikletë. Kanë katër herë më shumë gjasa të ndodhin tek meshkujt sesa tek femrat. Ato rrallë ndodhin para moshës dyvjeçare ose pas moshës 60-vjeçare. Në 70 % të raste hematomat epidurale ndodhin në lobin temporal të trurit.
SIMPTOMAT DHE SHKAQET
Kur një person pëson hematomë epidurale, ai përjeton një humbje të shkurtër të vetëdijes pas traumës së kokës. Kjo pasohet nga një periudhë vigjilence që mund të zgjasë për disa orë përpara se humbja e vetëdijes dhe funksioni i trurit të ulet sërish. Në disa njerëz, humbja e vetëdijes çon në koma.
Shenjat dhe simptomat e tjera të cilat shfaqen disa minuta deri në orë pas dëmtimit të kokës, përfshijnë: dhimbjen e fortë të kokës, nauzenë dhe të vjellat, bebëzat e zmadhuara në njërin sy, konfuzionin, të folurit e paqartë, marramendjen, dobësinë në njërën anë të trupit.
Nëse nuk trajtohet dhe gjakderdhja vazhdon, presioni i trurit rritet dhe simptomat mund të përkeqësohen me konvulsione, probleme me frymëmarrjen, humbje e funksionit të trurit, koma, vdekja.
ÇFARË E SHKAKTON HEMATOMËN EPIDURALE?
Hematoma epidurale shkaktohet zakonisht nga dëmtimi i kokës. Në 75% të rasteve ndodh nga fraktura e kafkës. Ajo që e dëmton arterien e mesme meningjeale është burimi më i zakonshëm i gjakderdhjes. Herë pas here, mund të formohet për shkak të gjakderdhjes nga një venë. Ndërsa shkaqet jotraumatike janë: infeksioni/abscesi, koagulopatia, tumoret hemorragjike (tumore që shkaktojnë gjakderdhje), keqformimet vaskulare (keqformimet arteriovenoze dhe ato kavernoze).
Hematomat epidurale të shtyllës kurrizore janë më së shpeshti gjakderdhje spontane nga venat, që shkaktohen nga koagulopatitë ose hollimi i tepërt i gjakut nga medikamentet antikoagulante. Shkaqe të tjera janë thyerjet, punksioni lumbal, anestezia epidurale, keqformimemet arteriovenoze kurrizore ose anomali të tjera vaskulare, tumoret e shtyllës kurrizore dhe shtatzënia.
DIAGNOZA
Hematoma epidurale diagnostikohet duke përdorur tomografinë e kompjuterizuar (TK) ose imazherinë me rezonancë magnetike (MRI) të kokës ose shtyllës kurrizore. Në kokë, hematoma shfaqet si një masë që e largon trurin nga kafka. Angjiogrami mund të kërkohet nëse dyshohet për një shkak jotraumatik, si një keqformim arteriovenoz.
MENAXHIMI DHE TRAJTIMI
Hematoma epidurale është zakonisht një urgjencë mjekësore që kërkon trajtim të menjëhershëm. Shenjat që imponojnë një trajtim kirurgjik janë kokëdhembja e fortë, dobësimi i funksioneve trunore dhe madhësia e hematomës. Pa intervenim kirurgjik për ta ulur presionin e trurit, mund të ketë dëmtim të përhershëm të trurit ose vdekje.
Nëse kemi një hematomë epidurale të shtyllës kurrizore, mund të kryhet laminektomia. Gjatë një laminektomie, një pjesë e vogël e kockës hiqet. Heqja e kockave lehtëson presionin në palcën kurrizore dhe rrënjët nervore të shkaktuar nga mpiksja e gjakut.
Ndonjëherë gjakderdhjet e vogla të trurit që nuk shkaktojnë presion në tru dhe shkaktojnë vetëm simptoma të lehta mund të menaxhohen pa kirurgji. Trupi mund të absorbojë një sasi të vogël gjaku me kalimin e kohës, zakonisht disa muaj. Nëse kemi një gjakderdhje të vogël në tru, gjendja do të monitoroheni nga afër me skanime të përsëritura të kokës për t'u siguruar që hematoma po shërohet.
MEDIKAMENTET
Pas intervenimit kirurgjik neurologu ose neurokirurgu mund të përshkruajë medikamente për ta reduktuar inflamacionin dhe presionin brenda trurit. Medikamentet që mund të përshkruhen përfshijnë manitolin, tretjen hipertonike dhe glicerinën. Një bar kundër konvulsioneve gjithashtu mund të përshkruhet për disa kohë pasi që konvulsionet ndonjëherë janë ndërlikim i lëndimeve të kokës.
Në terapi të rehabilitimit hyjnë terapia fizikale, terapia profesionale dhe/ose terapia e të folurit.
KOMPLIKIMET
Në grupin e komplikimeve nga intervenimi kirurgjik hyjnë: infeksioni (infeksion i plagës në prerje ose infeksione më të thella duke përfshirë meningjitin ose osteomielitin), hernia e trurit (presioni i rritur mund ta zhvendos indin e trurit nga pozicioni i tij normal dhe shpesh çon në vdekje), gjakderdhja (mund të jetë sipërfaqësore ose më e thellë dhe të jetë një hematomë e përsëritur që kërkon intervenim përsëri), konvulsionet, dëmtimi i trurit ose i palcës kurrizore, koma ose vdekja.
Përgatiti: Dr. Edita Malazogu
Redaktoi: Ass. Blerim Myftiu
DEMENCA FRONTOTEMPORALE
Demenca frontotemporale (FTD) është një term i përgjithshëm për një grup sëmundjesh të trurit që prekin kryesisht lobet frontale dhe temporale të trurit. Këto zona të trurit lidhen me personalitetin, sjelljen dhe gjuhën.
Në demencën frontotemporale, pjesët e këtyre lobeve e humbin vëllimin – term i njohur si atrofi. Simptomat varen nga pjesa e trurit që është prekur. Disa njerëz me demencë frontotemporale kanë ndryshime në personalitetin e tyre. Ata bëhen shoqërisht të papërshtatshëm dhe mund të jenë impulsivë ose emocionalisht indiferentë. Të tjerët humbasin aftësinë për të përdorur siç duhet gjuhën.
Demenca frontotemporale mund të diagnostikohet gabimisht si një gjendje e shëndetit mendor ose si sëmundja e Alzheimerit. Por FTD ndodhë në një moshë më të re se sa sëmundja e Alzheimerit. Shpesh fillon midis moshës 40 dhe 65 vjeç, megjithëse mund të ndodhë edhe më vonë në jetë. FTD është shkaku i demencës në rreth 10% deri në 20% të rasteve.
SIMPTOMAT
Simptomat e demencës frontotemporale ndryshojnë nga një person në tjetrin. Simptomat përkeqësohen me kalimin e kohës, zakonisht me kalimin e viteve.
Njerëzit me demencë frontotemporale priren të kenë grupe të llojeve të simptomave që ndodhin së bashku. Ata gjithashtu mund të kenë më shumë se një grup të llojeve të simptomave.
Simptomat më të zakonshme të demencës frontotemporale përfshijnë ndryshime ekstreme në sjellje dhe personalitet. Kjo përfshin:
- Sjelljen sociale gjithnjë e më të papërshtatshme.
- Humbjen e ndjeshmërisë dhe të aftësive të tjera ndërpersonale. Për shembull, të mos jetë i ndjeshëm ndaj ndjenjave të një personi tjetër.
- Mungesën e gjykimit.
- Humbjen e frenimit.
- Mungesën e interesit, e njohur edhe si apati. Apatia mund të ngatërrohet me depresionin.
- Sjelljen kompulsive, të tilla si trokitja, duartrokitja ose rrahja e buzëve pa pushim.
- Rënien e nivelit të higjienës personale.
- Ndryshimet në zakonet e të ngrënit. Njerëzit me FTD zakonisht hanë tepër ose preferojnë të hanë ëmbëlsira dhe karbohidrate.
- Dëshirën kompulsive për t'i vënë gjërat në gojë.
Disa nëntipa të demencës frontotemporale çojnë në ndryshime në aftësinë gjuhësore ose humbjen e të folurit. Nëntipat përfshijnë afazinë primare progresive, demencën semantike dhe afazinë progresive agramatike, të njohur gjithashtu si afazi progresive jofluente.
Këto gjendje mund të shkaktojnë:
- Probleme në rritje në përdorimin dhe të kuptuarit e gjuhës së shkruar dhe të folur. Njerëzit me FTD mund të mos jenë në gjendje të gjejnë fjalën e duhur për të përdorur në të folur.
- Probleme me emërtimin e gjërave. Njerëzit me FTD mund të zëvendësojnë një fjalë specifike me një fjalë më të përgjithshme.
- Nuk dinë më kuptimet e fjalëve.
- Kanë një fjalim hezitues që mund të tingëllojë telegrafik duke përdorur fjali të thjeshta me dy fjalë.
- Bërja e gabimeve në ndërtimin e fjalive.
Nëntipat e rralla të demencës frontotemporale shkaktojnë lëvizje të ngjashme me ato që shihen në sëmundjen e Parkinsonit ose sklerozën lateral amiotrofike (ALS). Simptomat e çrregullimit të lëvizjes mund të përfshijnë:
- Dridhjen.
- Ngurtësinë apo rigjiditetin.
- Spazmën ose dridhjen muskulore.
- Koordinimin e dobët.
- Problemet me gëlltitjen.
- Dobësinë muskulore.
- Të qeshura ose të qara të papërshtatshme.
- Rënien ose vështirësi në ecje.
SHKAQET
Në demencën frontotemporale, lobet frontale dhe temporale të trurit e humbin vëllimin dhe disa substanca depotizohen në tru. Çfarë i shkakton këto ndryshime zakonisht nuk dihet. Disa ndryshime gjenetike janë lidhur me demencën frontotemporale. Por më shumë se gjysma e njerëzve me FTD nuk kanë histori familjare të demencës. Studiuesit kanë konfirmuar se disa ndryshime të gjeneve të demencës frontotemporale shihen gjithashtu në sklerozën laterale amiotrofike (ALS). Më shumë kërkime po bëhen për të kuptuar lidhjen midis kushteve.
FAKTORËT E RREZIKUT
Rreziku për të vuajtur nga demenca frontotemporale është më i lartë nëse ekziston historia familjare e demencës. Nuk ka faktorë të tjerë të njohur rreziku.
Përgatiti: Dr. Leart Rruka
Redaktoi: Ass. Dr. Blerim Myftiu
GJAKDERDHJA (HEMATOMA) SUBDURALE
Hematoma subdurale zhvillohet nëse gjakderdhja ndodh në hapësirën midis kafkës dhe trurit (hapësira subdurale), e shkaktuar nga dëmtimi i enëve të gjakut të trurit ose të vetë trurit. Ndërsa ky gjak fillon të grumbullohet në hapësirën subdurale, ai mund të bëjë presion në tru (hipertension intrakranial) dhe mund të shkaktojë dëmtim të trurit. Lëndimet e kokës që shkaktojnë hematoma subdurale janë shpesh të rënda, të tilla si nga një aksident me makinë, rrëzimi ose sulmi i dhunshëm.
Cilat janë simptomat?
Simptomat e hematomës subdurale mund të zhvillohen menjëherë pas një dëmtimi të rëndë të kokës, ose gradualisht gjatë ditëve ose javëve pas një dëmtimi më të vogël të kokës. Ndonjëherë mund të mos mbani mend fare se keni goditur kokën. Ju mund të keni dhimbje koke që vazhdon të përkeqësohet, konfuzion, ndryshime në personalitet (të qenët jashtëzakonisht agresiv ose të keni luhatje të shpejta të humorit), ndiheni të përgjumur dhe të keni të vështirë t’i mbani sytë hapur, probleme me të folurit (të folurit e paqartë), probleme me shikimin (të parët dyfish), paralizë (humbje e lëvizjes) në njërën anë të trupit, probleme në ecje dhe rrëzime të shpeshta , konvulsione, humbje të vetëdijes.
Nëse pasi jeni rrëzuar keni filluar të keni këto simptoma, ose nuk e mbani mend se e keni goditur kokën, lajmërohuni menjëherë në qendrën më të afërt emergjente ose lajmërojeni urgjencën në numrin e telefonit 194.
Rrezik të shtuar për të pasur një hematomë kronike subdurale kanë personat që kanë epilepsi, hemofili (një gjendje që e çrregullon koagulimin normal të gjakut), që kanë shant ventrikuloperitoneal (një tub të hollë të implantuar në tru për ta larguar lëngun e tepërt trunoshpinor për ta trajtuar hidrocefalusin), aneurizëm të trurit (një fryrje në një nga enët e gjakut të trurit që mund të shpërthejë dhe të shkaktojë gjakderdhje në tru), tumore kanceroze (malinje) të trurit.
Diagnoza
Hematomat subdurale diagnostikohen në bazë të historisë mjekësore, simptomave dhe rezultateve të një skanimi të trurit.
Historia mjekësore: Mjeku që ju vlerëson në spital mund të dyshojë se keni hematomë subdurale nëse kohët e fundit e keni lënduar kokën dhe keni disa nga simptomat kryesore të një hematome subdurale, të tilla si konfuzioni ose një dhimbje koke e përkeqësuar. Gjithashtu është e rëndësishme ta informoni mjekun nëse merrni terapi antikoagulante ("hollues gjaku") për të parandaluar mpiksjen e gjakut, pasi kjo mund të rrisë rrezikun tuaj për hematomë subdurale.
Vlerësimi i simptomave tuaja: Do të ekzaminoheni për të parë nëse keni ndonjë shenjë fizike të një dëmtimi në kokë, si prerje dhe mavijosje. Testimi i bebëzave tuaja në reagim ndaj dritës do të përdoret si shenjë e një dëmtimi të trurit. Shkalla e komës sipas Glasgouit (GCS) gjithashtu do të përdoret për të kontrolluar nivelin e vetëdijes dhe për të ndihmuar në përcaktimin e ashpërsisë së çdo dëmtimi të trurit. Me anë të GCS ju vlerësoheni për përgjigjet tuaja verbale (aftësinë tuaj për të folur), reagimin tuaj motorik (nëse mund të lëvizni vullnetarisht ose në përgjigje ndaj ngacmuesve), si edhe për reagimin e syve apo të parët tuaj. Nëse rezultati juaj sugjeron se mund të ketë një problem me trurin, do të kryhet skanimi i trurit.
Skanimet e trurit: Shumica e njerëzve me hematomë subdurale do t’i nënshtrohen incizimit me tomografi të kompjuterizuar për ta konfirmuar diagnozën. Në disa raste mund të përdoret imazheria me rezonancë magnetike.
Trajtimi
Kirurgjia rekomandohet për shumicën e hematomave subdurale. Hematomat shumë të vogla subdurale mund të monitorohen me kujdes, fillimisht për të parë nëse ato shërohen pa kryer një operacion. Nëse rekomandohet operacioni, ai do të kryhet nga një neurokirurg (një ekspert në kirurgjinë e trurit dhe sistemit nervor). Ekzistojnë 2 teknika kirurgjikale të përdorura gjerësisht për trajtimin e hematomave subdurale:
Kraniotomia: Është trajtimi kryesor për hematomat subdurale që zhvillohet menjëherë pas dëmtimit të rëndë të kokës (hematoma akute subdurale). Nën anestezion të përgjithshëm, një pjesë e kafkës hiqet përkohësisht në mënyrë që kirurgu të ketë mundësi për të heqë hematomën. Pas procedurës, pjesa e kafkës vendoset përsëri në vend dhe sigurohet duke përdorur pllaka metalike ose vida.
Vrimat e vogla (burr holes): Kjo formë përdoret te hematomat subdurale që zhvillohen disa ditë ose javë pas një dëmtimi të vogël të kokës (hematoma subdurale kronike). Një vrimë e vogël hapet në kafkë dhe një tub futet përmes vrimës për ta ndihmuar drenimin e hematomës. Ndonjëherë tubi mund të lihet në vend për disa ditë më pas për të zvogëluar shanset që hematoma të rikthehet. Kjo formë e kirurgjisë shpesh kryhet nën anestezi të përgjithshme, por ndonjëherë kryhet nën anestezi lokale.
Rreziqet e operacionit - Si të gjitha operacionet, operacioni për hematomën subdurale bart një rrezik të komplikimeve. Shumica e këtyre komplikimeve janë të rralla, por ato mund të jenë serioze. Këtu përfshihen: gjakderdhja e mëtejshme në tru, infeksioni i plagës, mpiksja e gjakut në një venë të këmbës (trombozë e venave të thella), konvulsionet, insulti iskemik trunor. Ekziston gjithashtu mundësia që të mos hiqet e gjithë hematoma dhe që disa nga simptomat që keni pasur para operacionit të vazhdojnë. Këto mund të përmirësohen me kalimin e kohës ose mund të jenë të përhershme. Në disa raste, hematoma mund të kthehet gjatë ditëve ose javëve pas operacionit. Nëse kjo ndodh, mund të nevojitet një operacion tjetër për ta drenuar atë përsëri.
Kohëzgjatja që duhet për t'u rikuperuar nga një hematoma subdurale do të ndryshojë nga personi në person. Disa njerëz do të ndihen shumë më mirë pas disa javësh, ndërsa të tjerët nuk mund të shërohen kurrë plotësisht.
Përgatiti: Dr. Edita Malazogu
Redaktoi: Ass. Blerim Myftiu
DEMENCA VASKULARE
PËRKUFIZIMI
Demenca vaskulare është një term i përgjithshëm që I përshkruan problemet me arsyetimin, planifikimin, gjykimin, kujtesën dhe proceset e tjera të të menduarit, të shkaktuara nga dëmtimi i trurit nga qarkullimi i dëmtuar i gjakut në tru. Ajo mund të paraqitet si pasojë e një infarkti iskemik që e bllokon një arterie në tru, por iskemia nuk shkakton gjithmonë demencë vaskulare. Nëse një infarkt ndikon në të menduarit dhe arsyetim, varet nga ashpërsia dhe vendndodhja e sulmit iskemik. Demenca vaskulare mund të rezultojë gjithashtu nga kushte të tjera që dëmtojnë enët e gjakut dhe e reduktojnë qarkullimin, duke e privuar trurin nga oksigjeni dhe lëndët ushqyese jetike.
Faktorët që e rrisin rrezikun e sëmundjeve të zemrës dhe infarktit në tru – duke përfshirë diabetin, presionin e lartë të gjakut, kolesterolin e lartë dhe duhanin – rrisin gjithashtu rrezikun e demencës vaskulare. Kontrolli i këtyre faktorëve mund të ndihmojë në uljen e gjasave për zhvillimin e demencës vaskulare.
SIMPTOMAT
Simptomat e demencës vaskulare ndryshojnë, në varësi të pjesës së trurit ku rrjedhja e gjakut është e dëmtuar. Simptomat shpesh mbivendosen me ato të llojeve të tjera të demencës, veçanërisht demencës në sëmundjen e Alzheimerit. Por, ndryshe nga sëmundja e Alzheimerit, simptomat më të rëndësishme të demencës vaskulare janë ato që kanë të bëjnë me shpejtësinë e të menduarit dhe zgjidhjen e problemeve, se sa me humbjen e kujtesës.
Simptomat dhe shenjat e demencës vaskulare janë:
- Konfuzioni
- Problemet me vëmendjen dhe përqendrimin
- Aftësia e zvogëluar për të organizuar mendime ose veprime
- Rënie në aftësinë për të analizuar një situatë, për të zhvilluar një plan efektiv dhe për t'ua komunikuar atë plan të tjerëve
- Të menduarit e ngadalësuar
- Vështirësitë me organizimin
- Vështirësitë për të vendosur se çfarë të bëni më pas
- Probleme me kujtesën
- Shqetësimi dhe agjitacioni
- Ecja e paqëndrueshme
- Dëshira e papritur ose e shpeshtë për të urinuar ose pamundësia për ta kontrolluar urinën
- Depresioni ose apatia
Simptomat e demencës vaskulare mund të jenë më të qarta kur ato shfaqen papritur pas një infakti në tru. Kur ndryshimet në të menduar dhe arsyetim duken qartë të lidhura me një iskemi në tru, kjo gjendje quhet nganjëherë demenca pas infarktit.
Simptomat e demencës vaskulare shfaqen ndonjëherë pas disa sulmeve të vogla të trurit. Ndryshimet në proceset e të menduarit ndodhin me hapa të përshpejtuar, por të dukshëm, nga niveli i mëparshëm i funksionit, ndryshe nga rënia graduale dhe e qëndrueshme që zakonisht ndodh në demencën te sëmundja e Alzheimerit. Por demenca vaskulare gjithashtu mund të zhvillohet shumë gradualisht, ashtu si demenca e sëmundjes së Alzheimerit. Për më tepër, sëmundja vaskulare dhe sëmundja e Alzheimerit shpesh zhvillohen së bashku. Studimet tregojnë se shumë njerëz me demencë dhe dëshmi të sëmundjeve vaskulare të trurit kanë gjithashtu sëmundjen e Alzheimerit.
SHKAQET
Demenca vaskulare rezulton nga shkaqet që i dëmtojnë enët e gjakut të trurit, duke reduktuar aftësinë e tyre për ta furnizuar trurin me sasinë e domosdoshme të gjakut dhe të oksigjenit që i nevojitet për të kryer proceset e të menduarit në mënyrë efektive.
Infarktet e mëdha që e bllokojnë një arterie të trurit zakonisht shkaktojnë një sërë simptomash që mund të përfshijnë edhe demencën vaskulare. Ndonjëherë, disa goditje të heshtura rrisin rrezikun e demencës. Me goditjet e heshtura dhe ato të dukshme, rreziku i demencës vaskulare rritet me numrin e goditjeve që ndodhin me kalimin e kohës. Lloji i demencës vaskulare që përfshin shumë goditje quhet demenca me shumë infarkte.
Gjakderdhjet e trurit shpesh shkaktohet nga presioni i lartë i gjakut. Dobësimi i enës së gjakut që çon në gjakderdhje në tru shkaktohet nga grumbullimi i proteinave në enët e vogla të gjakut – proces që ndodh me plakjen duke i dobësuar ato me kalimin e kohës (angjiopatia amiloide cerebrale)
FAKTORËT E RREZIKUT
Në përgjithësi, faktorët e rrezikut për demencën vaskulare janë të njëjtë me ata për sëmundjet e zemrës dhe sulmit në tru. Faktorët e rrezikut për demencën vaskulare përfshijnë:
- Moshën - Rreziku i demencës vaskulare rritet me plakjen. Çrregullimi është i rrallë para moshës 65-vjeçe dhe rreziku rritet ndjeshëm në të 90-at.
- Historia e infarkteve në zemër, infarkteve në tru ose goditjeve të vogla - Nëse keni pasur një atak në zemër, mund të jeni në rrezik të shtuar për të pasur probleme me enët e gjakut në tru. Dëmtimi i trurit që ndodh me një goditje në tru ose një goditje të vogël (sulm ishemik kalimtar) mund të rrisë rrezikun e zhvillimit të demencës.
- Plakja jonormale e enëve të gjakut (ateroskleroza) - Kjo gjendje ndodh kur depozitat e kolesterolit dhe substancave të tjera (pllakat) grumbullohen në arteriet dhe ngushtojnë enët e gjakut. Ateroskleroza mund të rrisë rrezikun e demencës vaskulare duke reduktuar rrjedhën e gjakut që e ushqen trurin.
- Kolesteroli i lartë - Nivelet e ngritura të lipoproteinës me densitet të ulët (LDL), kolesteroli "i keq", shoqërohen me një rrezik në rritje të demencës vaskulare.
- Presioni i lartë i gjakut - Kur tensioni i gjakut është shumë i lartë, ai ushtron stres shtesë në enët e gjakut kudo në trup, duke e përfshirë trurin. Kjo e rrit rrezikun e problemeve vaskulare në tru.
- Diabeti - Nivelet e larta të glukozës dëmtojnë enët e gjakut në të gjithë trupin. Dëmtimi në enët e gjakut të trurit mund të rrisë rrezikun e goditjes në tru dhe demencës vaskulare.
- Pirja e duhanit - Pirja e duhanit dëmton drejtpërdrejt enët e gjakut, duke e rritur rrezikun e aterosklerozës dhe sëmundjeve të tjera të qarkullimit të gjakut, duke përfshirë demencën vaskulare.
- Obeziteti - Të qenët mbipeshë është një faktor i njohur rreziku për sëmundjet vaskulare në përgjithësi, dhe për këtë arsye, me sa duket rrit rrezikun e demencës vaskulare.
- Fibrilacioni atrial - Në këtë ritëm jonormal të zemrës, parabarkushet e zemrës fillojnë të rrahin shpejt dhe në mënyrë të parregullt, jashtë koordinimit me barkushet zemrës. Fibrilacioni atrial e rrit rrezikun e goditjes në tru, sepse shkakton formimin e mpiksjes së gjakut në zemër që mund të shkëputet dhe të shkojë në enët e gjakut të trurit.
PARANDALIMI
Shëndeti i enëve të gjakut të trurit është i lidhur ngushtë me shëndetin E përgjithshëm të zemrës. Marrja e këtyre hapave për të mbajtur zemrën të shëndetshme mund të ndihmojë gjithashtu në uljen e rrezikut të demencës vaskulare:
- Mbani një presion të shëndetshëm të gjakut - Mbajtja e presionit të gjakut në intervalin normal mund të ndihmojë në parandalimin e demencës vaskulare dhe të sëmundjes së Alzheimerit.
- Parandaloni ose kontrolloni diabetin - Shmangia e shfaqjes së diabetit të tipit 2, me dietë dhe stërvitje, është një mënyrë tjetër e mundshme për ta ulur rrezikun e demencës. Nëse tashmë keni diabet, kontrolli i niveleve të glukozës mund të ndihmojë në mbrojtjen e enëve të gjakut të trurit nga dëmtimi.
- Lini duhanin - Pirja e duhanit dëmton enët e gjakut kudo në trupin tuaj.
- Bëni ushtrime fizike - Aktiviteti i rregullt fizik duhet të jetë një pjesë kyçe e planit të mirëqenies së secilit. Përveç të gjitha përfitimeve të tjera, stërvitja mund t'ju ndihmojë të shmangni demencën vaskulare.
- Mbani në kontroll kolesterolin tuaj - Një dietë e shëndetshme, me pak yndyrë dhe medikamente për uljen e kolesterolit, nëse keni nevojë për to, mund të zvogëlojnë rrezikun e goditjeve në tru dhe sulmeve në zemër që mund të çojnë në demencë vaskulare, ndoshta duke reduktuar sasinë e depozitave të pllakave që grumbullohen brenda arterieve të trurit tuaj.
Përgatiti: Dr. Leart Rruka
Redaktoi: Ass. Dr. Blerim Myftiu
SËMUNDJA E MOTONEURONIT (SKLEROZA AMIOTROFIKE LATERALE)
HYRJE
Sëmundja e neuronit motor (motor neuron disease - MND) është një gjendje e rrallë që dëmton në mënyrë progresive pjesën motorike të sistemit nervor duke shkaktuar dobësimin e muskujve. MND-ja shfaqet kur qelizat e veçanta nervore në tru dhe palcën kurrizore, të cilat quhen neurone motorike, ndalojnë së funksionuari siç duhet dhe vdesin para kohe. Ky proces njihet si neurodegjenerim. Neuronet motorike udhëheqin aktivitetin e muskujve që kontrollojnë ecjen, të folurit, gëlltitjen dhe frymëmarrjen; andaj me përparimin e MND-së vështirësohet ose pamundësohet kryerja e këtyre aktiviteteve.
KUSH KA MË SHUMË GJASA TË PREKET NGA SËMUNDJA E MOTONEURONIT?
MND-ja shfaqet si te të rriturit ashtu edhe te fëmijët. Te fëmijët, MND-ja paraqitet zakonisht për shkak të mutacioneve specifike të gjeneve, si në rastin e atrofisë muskulore kurrizore. Simptomat mund të jenë të pranishme në lindje ose të shfaqen në fëmijërinë e hershme. Te të rriturit, MND-ja ka më shumë gjasa të jetë sporadike, që do të thotë se sëmundja shfaqet pa histori familjare. Simptomat zakonisht shfaqen pas moshës 50-vjeçare, megjithëse fillimi i sëmundjes mund të paraqitet në çdo moshë.
Fatkeqësisht, deri më sot nuk ka shërim për MND-në. Trajtimi simptomatik dhe mbështetës mund t'i ndihmojë personat me MND të kenë jetë të rehatshme duke cilësore, aq sa është e mundur. Klinikat multidisciplinare, me specialistë të neurologjisë, terapisë fizikale, terapisë së frymëmarrjes dhe punës sociale janë veçanërisht të rëndësishme në kujdesin e individëve me MND.
ALS
Forma më e përhapur dhe më e njohur e MND-së është ALS (amyotrophic lateral sclerosis – skleroza amiotrofike laterale). ALS-ja është një sëmundje e sistemit nervor që prek qelizat nervore në tru dhe në palcën kurrizore. Ajo gradualisht shkakton humbje të kontrollit të muskujve. Sëmundja përkeqësohet me kalimin e kohës. ALS-ja shpesh quhet sëmundja e Lou Gehrigut, emëruar sipas lojtarit të bejsbollit, i cili u diagnostikua me këtë sëmundje dhe u detyrua të pensionohej në moshën 36-vjeçare. Shkaktari i saktë i ALS-së ende nuk dihet. Një numër i vogël i rasteve janë të trashëguara. Shpesh fillon me dridhje të muskujve dhe dobësim të krahëve dhe këmbëve, vështirësi në gëlltitje ose të folur të paqartë. Ndikon drejtpërdrejt në kontrollimin e muskujve të nevojshëm për lëvizje, ngrënie, frymëmarrje dhe për të folur. Kjo sëmundje fatale është, fatkeqësisht, ende e pashërueshme.
Incidenca e ALS-së është afërsisht 1-2,6 raste për 100 mijë persona në vit, ndërsa prevalenca është afërsisht 6 raste për 100 mijë banorë. Mosha mesatare e shfaqjes së ALS-së është 58-60 vjeç dhe mbijetesa mesatare nga fillimi deri në vdekje është 3-4 vite.
PASQYRA KLINIKE
Simptomat e ALS-së ndryshojnë nga personi në person dhe varen nga tipi i qelizave nervore të prekura. ALS-ja në përgjithësi fillon me dobësim muskulor që zhvillohet dhe përkeqësohet me kalimin e kohës. Këto simptoma mund të përfshijnë:
• Vështirësinë në ecje ose kryerjen e aktiviteteve të zakonshme të përditshmërisë.
• Rrëzimin.
• Dobësimin e këmbëve, shputave ose nyjave të këmbëve.
• Dobësimin ose ngathtësinë e duarve.
• Të folurit e paqartë ose probleme me gëlltitjen.
• Dobësimin e shoqëruar me ngërçe të muskujve dhe dridhje të pavullnetshme në krahë, shpatulla dhe gjuhë.
• Ndryshimet e të menduarit ose të sjelljes.
Në përgjithësi, në fazat e hershme të ALS-së nuk ka dhimbje. Dhimbja është po ashtu e pazakontë edhe në fazat e mëvonshme. ALS-ja zakonisht nuk ndikon në kontrollimin e fshikëzës urinare dhe të shqisave, pra aftësinë për të shijuar, nuhatur, prekur dhe dëgjuar.
KOMPLIKIMET E ALS-së
Problemet me frymëmarrjen
Me kalimin e kohës, ALS-ja çon në dobësimin e muskujve të frymëmarrjes. Njerëzit me ALS mund të kenë nevojë për maskë oksigjeni gjatë natës që t’u lehtësohet frymëmarrja. Te disa njerëz me ALS të avancuar mjekët zgjedhin të bëjnë trakeostomi. Trakeostomia është një vrimë e hapur në mënyrë kirurgjikale në pjesën e përparme të qafës që e çon ajrin në trake. Shkaku më i zakonshëm i vdekjes së pacientëve me ALS është pamjaftueshmëria e frymëmarrjes. Gjysma e pacientëve me ALS vdesin brenda 14-18 muajve nga momenti i diagnostikimit. Megjithatë, disa njerëz me ALS jetojnë 10 vjet ose më shumë. Rasti i rrallë i shkencëtarit Stephen Hawking është botërisht i njohur. Ai u diagnostikua me ALS në moshën 21-vjeçare, ndërkohë që studionte fizikë në Universitetin Oxford. Jetoi me ALS dhe pavarësisht sëmundjes publikoi dhjetëra punime shkencore dhe shkroi disa libra, duke fituar shume çmime për arritje shkencore. Jetoi deri në moshën 76-vjeçare.
Vështirësitë në të folur
Shumica e njerëzve me ALS zhvillojnë dobësim të muskujve të të folurit. Ky dobësim zakonisht fillon me të folur më të ngadaltë, hundor dhe ngatërrim të herëpashershëm të fjalëve. Më pas rëndohet të folurit qartë deri në atë pikë sa është shumë e vështirë të kuptohet biseda e personit me ALS.
Vështirësitë në të ushqyer
Te njerëzit me ALS gradualisht mund të zhvillohet dobësimi i muskujve të gëlltitjes. Kjo mund të çojë në kequshqyerje dhe dehidrim. Ata gjithashtu rrezikohen nga kalimi aksidental i ushqimit, lëngjeve ose pështymës në mushkëri, gjë që mund të shkaktojë pneumoni. Vendosja e sondës nazogastrike mund të zvogëlojë këtë rrezik dhe të sigurojë hidratimin dhe ushqyerjen adekuate, në fazat e përparuara të sëmundjes.
Demenca
Disa njerëz me ALS kanë probleme me gjuhën e folur dhe vendimmarrjen. Disa përfundimisht diagnostikohen me një formë të demencës të quajtur demencë frontotemporale.
DIAGNOSTIKIMI
ALS-ja mund të jetë e vështirë për t'u diagnostikuar në fillim sepse mund të ketë simptoma të ngjashme me sëmundjet e tjera.
Nuk ka ndonjë metodë specifike për diagnostikimin e ALS-së. Diagnoza bazohet kryesisht në pasqyrën klinike tipike dhe ecurinë e sëmundjes. Megjithatë, ekzistojnë disa metoda në të cilat neurologu bazohet për të përjashtuar sëmundjet tjera dhe për të dhënë një diagnozë përfundimtare:
- Elektromioneurografia (EMNG). Gjilpëra e futur përmes lëkurës në muskuj të ndryshëm e regjistron aktivitetin elektrik të muskujve gjatë tkurrjes dhe relaksimit si dhe shkallën e dëmtimit nervor.
- Rezonanca magnetike – Te personat me ALS, imazheria me rezonancë magnetike mund të shfaqë ndryshime specifike për këtë sëmundje. Me këtë rast mund të bëhet përjashtimi i dyshimeve për gjendje tjera të ngjashme, siç janë: tumoret e palcës kurrizore si dhe hernitë e qafës.
- Analizat e gjakut dhe urinës – Analizimi i mostrave të gjakut dhe urinës në laborator mund të ndihmojë në eliminimin e shkaqeve të tjera të mundshme të simptomave.
- Punksioni lumbal – Kjo procedurë bëhet për të marrë një mostër të lëngut trunoshpinor dhe testimit laboratorik të tij. Procedura, e cila kryhet nga neurologu, bëhet duke futur një gjilpërë të vogël në hapësirën midis dy unazave në pjesën e poshtme të belit dhe marrjen e pak mililitrave lëng trunoshpinor për analizë.
MJEKIMI
Trajtimet nuk mund ta rikthejnë dëmtimin e shkaktuar nga ALS-ja, por mund ta ngadalësojnë përparimin e simptomave. Ato gjithashtu mund të ndihmojnë në parandalimin e komplikimeve dhe të mundësojnë një jetë më të pavarur dhe cilësore, aq sa është e mundur. ALS-ja është sëmundje që ka nevojë për trajtim multidisciplinar, që do të thotë se mjekët e lëmive të ndryshme angazhohen për arritjen e rezultateve më të mira. Natyrisht, trajtimi fillestar dhe kryesor nis me neurologun.
Po ashtu, angazhohet fiziatri për rekomandimin e llojit të terapisë fizikale, meqenëse ushtrimet e lehta janë thelbësorë për parandalimin e kontrakturave dhe ngërçeve. Gastroenterologu për trajtimin e simptomave të traktit digjestiv si kapsllëku dhe kequshqyerja. Pulmologu për trajtimin e kollës dhe këlbazës dhe komplikimeve respiratore. Psikiatri, për trajtimin e depresionit eventual dhe problemet me gjumin. Logopedi, mund të mësojë teknika adaptive për ta bërë komunikimin më të kuptueshëm. Ushtrimet e rregullta gjithashtu mund të ndihmojnë në përmirësimin e ndjenjës së mirëqenies. Shtrirja e duhur mund të ndihmojë në parandalimin e dhimbjes dhe t’i ndihmojë muskujt të funksionojnë sa më mirë.
BARNAT
Riluzole është ilaçi i parë i miratuar nga Administrata amerikane e Ushqimit dhe Barnave (FDA) për trajtimin e ALS-së. Megjithatë, ky bar nuk mund të kthejë dëmtimin e shkaktuar tashmë tek neuronet motorike.
Edaravone, një antioksidant i miratuar nga FDA-ja për trajtimin e ALS-së, ngadalëson rënien e funksionit fizik dhe parandalon përparimin e sëmundjes.
Nusinersen, ilaçi i parë për trajtimin e fëmijëve dhe të rriturve me SMA të miratuar nga FDA-ja, është lloji i trajtimit i quajtur si terapi oligonukleotide dhe funksionon duke e rritur proteinën SMN, e nevojshme për funksionimin normal të muskujve dhe nervave.
Terapia gjenetike Onasemnogeme (Zolgensma) u miratua nga FDA-ja për fëmijët më pak se 2 vjeç që kanë SMA me fillimin infantile, i cili përmirëson lëvizjen dhe funksionimin e muskujve, dhe gjithashtu përmirëson mbijetesën.
Relaksuesit e muskujve si baklofeni, tizanidini dhe benzodiazepinat mund të zvogëlojnë rigjiditetin e muskujve dhe të ndihmojnë zbutjen e spazmave muskulore. Injeksionet e toksinës së botulinës mund të përdoren për të trajtuar ngurtësinë e muskujve duke dobësuar muskujt tepër aktivë. Ato, po ashtu mund të injektohen në gjëndrat e pështymës për të zvogëluar mbiprodhimin. Pështyma e tepërt gjithashtu mund të trajtohet me medikamente të tilla si amitriptilini dhe atropina.
TERAPITË MBËSHTETËSE
Ushqimi i duhur dhe dieta e ekuilibruar janë thelbësore për ta ruajtur peshën trupore dhe forcën muskulore. Njerëzit që nuk mund të përtypin ose gëlltisin mund të kenë nevojë për sondë nazogastrike (gyp ushqimi).
Ventilimi me presion pozitiv joinvaziv (NIPPV), i njohur gjithashtu si ventilator, mund të parandalojë apnenë e gjumit gjatë natës. Disa individë mund të kenë nevojë gjithashtu për ventilim të asistuar gjatë ditës për shkak të dobësimit të muskujve të qafës, fytit dhe gjoksit.
Bazuar në të kuptuarit aktual të ALS, studiuesit po kryejnë hulumtime klinike për ilaçet dhe trajtimet janë premtuese.
Referencat:
Përgatiti: Dr. Pranvera Bytyqi
Redaktoi: Ass. Dr. Blerim Myftiu
GJAKDERDHJA SUBARAKNOIDALE
CILËT JANË SHKAKTARËT?
Shkaku më i shpeshtë i gjakderdhjes subaraknoidale në tru është aneurizmi i rupturuar. Aneurizmi është fryrje nga jashtë në murin e një ene gjaku e shkaktuar nga një pikë e dobët në murin e saj. Ndërsa gjaku kalon nëpër enën me mur të dobësuar, presioni bën që një zonë e vogël të fryhet nga jashtë si një ballonë. Herë pas here, kjo fryrje mund të pëlcas, duke shkaktuar gjakderdhje rreth trurit. Më shumë se 8 në çdo 10 hemorragji subaraknoidale ndodhin në këtë mënyrë. Aneurizmi në tru zakonisht nuk shkakton asnjë simptomë nëse nuk çahet (rupturohet). Por disa njerëz mund të përjetojnë simptoma të tilla si: probleme me shikimin, dhimbje në njërën anë të fytyrës ose rreth syrit, dhimbje koke të vazhdueshme. Nuk dihen arsyet pse zhvillohen aneurizmat e trurit, megjithëse janë identifikuar disa faktorë rreziku, ku bëjnë pjesë: pirja e duhanit, presioni i lartë i gjakut, konsumimi i tepruar i alkoolit, historia familjare pozitive, lëndimet e rënda të kokës, sëmundja autosomale dominante e veshkave polikistike (ADPKD).
SIMPTOMAT KRYESORE:
- dhimbja e kokës e papritur e rëndë, ndryshe nga ajo që është përjetuar më parë
- qafa e shtanguar
- ndjeshmëria e rritur ndaj dritës (fotofobi)
- të parët i paqartë ose i dyfishtë
- simptoma të ngjashme me goditjen në tru – të tilla si të folurit të paqartë dhe dobësim të njërës anë të trupit
- humbje e vetëdijes ose konvulsione (dridhje të pakontrollueshme të trupit)
Hemorragjia subaraknoidale është një urgjencë mjekësore. Telefononi menjëherë 194 dhe kërkoni ndihmë të shpejtë nëse ju ose dikush tjetër afër jush ka këto simptoma!
DIAGNOSTIKIMI
Pas arritjes në spital mjeku do ta udhëzojë realizimin e tomografisë së kompjuterizuar. Gjithashtu mund të nevojitet testi që quhet punksion lumbal (me anë të një gjilpëre merret një sasi e vogël e lëngut trunoshpinor që e mbështjell trurin dhe palcën e kurrizit, e cila dërgohet në laborator në mënyrë që të vlerësohet për shenja të gjakderdhjes).
Në mënyrë që të planifikohet trajtimi, nevojiten teste të mëtejshme të cilat mund të përfshijnë:
- Angjiografinë me tomografi të kompjuterizuar (TKA)
- Angjiografinë me rezonancë magnetike (MRA)
Të dyja këto teste kryhen në të njëjtën mënyrë si skanimi i zakonshëm i TK-së, por substanca e kontrastit injektohet në venë (zakonisht në krah ose dorë) për t’i vizualizuar më mirë enët e gjakut.
Në disa raste mund të jetë i nevojshëm që të realizohet angjiogrami – i cili kryhet me futjen e një tubi të hollë të quajtur kateter në një nga enët gjakut (zakonisht në ijë). Paraprakisht në vendin ku futet kateteri, përdoret anestetiku lokal në mënyrë që mos të ndihet dhimbja. Duke përdorur një seri rrezesh X të shfaqura në një monitor, kateteri drejtohet në enët e gjakut në qafë që furnizojnë trurin me gjak. Pasi të vendoset në vendin e duhur, kontrasti injektohet përmes kateterit për në arteriet e trurit. Kontrasti jep një hije kështu që mund të shihet korniza e enëve të gjakut dhe të identifikohet vendndodhja e saktë e aneurizmit.
TRAJTIMI
- Medikamentet: 1) Nimodipina – jepet në formë orale, zakonisht për 3 javë derisa të kalojë rreziku i iskemisë cerebrale sekondare. Iskemia cerebrale sekondare është një nga ndërlikimet kryesore të një hemorragjie subaraknoidale. Furnizimi me gjak në tru zvogëlohet në mënyrë të rrezikshme, duke ndërprerë në këtë mënyrë funksionet normale të trurit dhe duke shkaktuar dëmtim të trurit. Efektet anësore të nimodipinës janë të rralla, por mund të përfshijnë skuqjen e lëkurës, rritjen e rrahjeve të zemrës, dhimbjen e kokës. 2) Medikamente për lehtësim të kokëdhembjes – zakonisht përdoret morfina ose kombinim i kodeinës me paracetamol. 3) Medikamente të tjera: antikonvulsantët si fenitoina - të cilat mund të ndihmojnë në parandalimin e konvulsioneve, antiemetikët, të tillë si prometazina - të cilat mund t'ju ndihmojnë në trajtimin e vjelljeve.
- Kirurgjia dhe procedurat: Nëse hemorragjia subaraknoidale është shkaktuar nga një aneurizëm e trurit, mund të rekomandohet intervenimi kirurgjik për ta riparuar enën e prekur të gjakut dhe për të parandaluar aneurizmin që të shpërthejë përsëri. Kjo mund të kryhet duke përdorur një nga 2 teknikat kryesore, të cilat kryhen nën anestezi të përgjithshme, që do të thotë se do të jeni në gjumë gjatë gjithë operacionit. Lloji i procedurës së përdorur do të varet nga shëndeti juaj dhe pozicioni i aneurizmit.
“Coiling” konsiderohet shpesh si teknika e preferuar, sepse ka një rrezik më të ulët të komplikimeve afatshkurtra të tilla si konvulsionet, megjithëse përfitimet afatgjata janë të pasigurta. Pacientët që kanë kryer procedurën e coilingut zakonisht lirohen nga spitali më shpejt dhe koha e përgjithshme e rikuperimit mund të jetë më e shkurtër. Por kur këto lloj operacionesh kryhen si procedura urgjente, koha e rikuperimit dhe qëndrimi në spital varen më shumë nga shkalla e rupturës sesa nga lloji i intervenimit kirurgjik të përdorur. Ndonjëherë për shkak të rrezikshmërisë së intervenimit mund të trajtoheni në mënyrë konservative.
KOMPLIKIMET E HERSHME
- Rigjakderdhja - Një ndërlikim i hershëm dhe serioz i një hemorragjie subaraknoidale është aneurizmi i trurit që shpërthen sërish pasi mbyllet vetë. Kjo njihet si rigjakderdhje. Rreziku i rigjakderdhjes është më i lartë disa ditë pas hemorragjisë së parë dhe bart një rrezik të lartë të paaftësisë së përhershme ose vdekjes. Për shkak të kësaj, riparimi i aneurizmit është i nevojshëm sa më shpejt të jetë i mundur.
- Vazospazmi - I quajtur edhe iskemi cerebrale e vonuar, ndodh kur një enë gjaku kalon në një spazmë, duke shkaktuar ngushtimin e enës. Furnizimi me gjak në tru zvogëlohet në mënyrë të rrezikshme, duke ndërprerë funksionet normale të trurit dhe duke shkaktuar dëmtim të trurit. Zakonisht ndodh disa ditë pas hemorragjisë së parë. Simptomat e zakonshme janë përgjumja, e cila mund të kalojë në koma, me ose pa simptoma të tjera të ngjashme me goditjen në tru, si dobësim i njërës anë të trupit. Ka shumë trajtime që mund të përdoren për të parandaluar dhe trajtuar vazospazmin duke përfshirë këtu nimodipinën.
- Hidrocefalusi - Nënkupton grumbullimin e lëngut në tru, rrjedhimisht duke rritur presionin në tru dhe duke shkaktuar dëmtim të mundshëm të tij. Në grupin e simptomave hyjnë: dhimbja e kokës, shikimi i turbullt, vështirësia në ecje. Hidrocefalusi është i zakonshëm pas hemorragjisë subaraknoidale, pasi çrregullohet prodhimi dhe drenimi i lëngut trunoshpinor (LTSH). LTSH-ja është një lëng që mbështjell trurin dhe palcën kurrizore, prodhohet dhe absorbohet vazhdimisht, duke e ripërtërirë veten. Hidrocefalusi mund të trajtohet me punksion lumbal ose me një tub të përkohshëm që implantohet në mënyrë kirurgjikale në tru për të drenuar lëngun e tepërt.
KOMPLIKIMET E VONSHME
- Epilepsia - funksionimi normal i trurit ndërpritet duke rezultuar në këtë mënyrë që një person të ketë konvulsione (dridhje të pavullnetshme të trupit). Ekzistojnë lloje të ndryshme të konvulsioneve dhe simptomat ndryshojnë. Konvulsionet zakonisht zgjasin nga disa sekonda deri në disa minuta përpara se aktiviteti i trurit të kthehet në normalitet. Kur epilepsia lajmërohet pas një hemorragjie subaraknoidale, kriza e parë zakonisht ndodh në vitin pas hemorragjisë. Rreziku për të pasur një konvulsion zvogëlohet me kalimin e kohës. Epilepsia mund të trajtohet duke përdorur medikamente antiepileptike, të tilla si fenitoini ose karbamazepini. Specialisti neurolog do t'ju ndihmojë të vendosni se cili trajtim ju nevojitet dhe për sa kohë ju duhet ta merrni atë.
- Çrregullimi kognitiv është një ndërlikim i zakonshëm i një hemorragjie subaraknoidale, që prek shumicën e njerëzve dhe paraqitet në formë të vështirësive kognitive, siç është problemi i kujtesës (kujtimet para hemorragjisë normalisht nuk preken, por mund të ketë probleme me kujtimin e informacione të reja); vështirësia në planifikim (detyra të thjeshta, të tilla si përgatitja e një filxhan çaji), vështirësia me përqendrimin ose vëmendjen.
- Çrregullimet emocionale - janë një tjetër ndërlikim i zakonshëm dhe afatgjatë i një hemorragjie subaraknoidale. Forma e saj më e shprehur është depresioni.
- Çrregullimi i stresit post-traumatik (PTSD) – ku një person shpesh përjeton një ngjarje të mëparshme traumatike (në këtë rast hemorragjinë) përmes maktheve dhe rikthimeve, mund të shoqërohet me ndjenja izolimi, nervozizmi dhe faji.
RIKUPERIMI
Koha që duhet për t'u rikuperuar nga një hemorragji subaraknoidale varet nga ashpërsia e saj. Vendndodhja e hemorragjisë do të ndikojë gjithashtu nëse do të kemi si shembull humbje të ndjeshmërisë në krahë ose këmbë, ose probleme me të kuptuarit e të folurit (afazi).
Rikuperimi mund të jetë një proces frustrues. Do të ketë ditë të mira dhe ditë të këqija.
Ndjenjat e zemërimit, pakënaqësisë dhe trishtimit janë të zakonshme. Biseda me njerëz të tjerë përmes grupeve mbështetëse, mund t’ju ofrojë ndihmë dhe siguri. Një vlerësim nga një psikolog klinik gjithashtu mund të jetë i dobishëm. Ka shumë specialistë që mund të përfshihen në shërimin tuaj, duke hyrë këtu: fiziatri, fizioterapistët, logopedi/terapistët e të folurit, terapistë profesionistë - specialistë që identifikojnë problemet që mund të keni në jetën e përditshme, si shembull për tu veshur dhe mund t'ju ndihmojnë të gjeni zgjidhje praktike.
Të tjera ankesa të zakonshme që mund të keni gjatë procesit të rikuperimit dhe do të përmirësohen gradualisht janë: Lodhje/plogështi e përgjithshme trupore, probleme me gjumin/ pagjumësi, dhimbje koke, ndjesi të çuditshme ose të pazakonta. Nuk është e qartë pse ndodhin këto ndjesi të çuditshme, por ato janë të zakonshme dhe zakonisht kalojnë me kalimin e kohës. Ndryshime në shqisat - shumë njerëz përjetojnë ndryshime në shqisën e tyre të nuhatjes dhe shijes pasi kanë pasur një hemorragji subaraknoidale. Ushqimi i preferuar tani ka shije të neveritshme, ndërsa diçka që e urrenit tani ka shije të shijshme. Por këto ndryshime në shqisa janë normalisht të përkohshme dhe do të zgjidhen me uljen e ënjtjes në tru. Të pamurit: Pas një dëmtimi të trurit, problemet me shikimin tuaj, të tilla si mjegullimi, pikat e verbra, pikat e zeza dhe shikimi i dyfishtë, janë të zakonshme. Nëse është e nevojshme, ju do të referoheni te një okulist (një mjek i specializuar në kujdesin e syrit) për analiza dhe trajtim të mëtejshëm. Problemet e shikimit zakonisht përmirësohen gradualisht gjatë disa muajve.
Përgatiti: Dr. Edita Malazogu
Redaktoi: Ass. Dr. Blerim Myftiu
TRAJTIMI JOFARMAKOLOGJIK I EPILEPSISË REFRAKTORE
Shkruan: Dr. Melihate Pushka, Mr.sci.
Klinika e Neurologjisë, QKUK, SHSKUK
Epilepsia është një ndër çrregullimet neurologjike më të shpeshta, e krahasueshme ndoshta vetëm me kokëdhembjet dhe sëmundjet cerebrovaskulare. Sipas statistikave të SHBA-së, 1.2% e populatës së saj vuan nga epilepsia aktive (1). Në Kosovë, fatkeqësisht kemi mungesë të databazës së mirëfilltë me të dhënat e pacientëve me epilepsi, ndaj mund vetëm të bëjmë një përllogaritje të përafërt krahasuar me numrat botërorë. Kështu, bazuar në numrin zyrtar të Agjencisë së Statistikave, të vitit 2020, numri i gjithmbarshëm i të sëmurëvë me epilepsi në Kosovë do të duhej të ishte 21.600. Nga ky numër, 30% janë me epilepsi refraktore, pra ata që nuk mund të mjekohen me sukses përkundër trajtimit me farmakoterapinë aktuale antiepileptike, d.m.th i bie diku rreth 6.480 banorë. Numrat janë mjaft mbresëlënëse, por jo edhe trajtimi i tyre në vendin tonë, sidomos krahasuar me vendet e zhvilluara ku ekzistojnë dhe janë duke u hulumtuar një sërë opsionesh të reja dhe mjaft shpresëdhënëse për këta pacientë. Natyrisht për disa prej tyre, ende duhen bërë përparime të konsiderueshme para se të futen në protokolet e trajtimit standard klinik.
Epilepsia definohet si çrregullim kronik neurologjik, i karakterizuar me predispozitën e vazhdueshme të trurit për kriza epileptike të paprovokuara. Mjekohet me medikamentet antiepileptike në dispozicion, me monoterapi ose në kombinim të dy apo më tepër medikamenteve. Rreth 1/3 e gjithë pacientëve me epilepsi kanë epilepsi të patrajtueshme, e ashtuquajtura epilepsi refraktore (2). Me fjalë tjera janë këta pacientë pa kurrfarë përgjigjje terapeutike ndaj 2-3 llojeve të terapisë antiepileptike që e marrin rregullisht. Kjo si pasojë ka efekt fundamental dhe shkatërrues në jetën apo thënë më mirë në funksionalitetin e tyre të përditshëm.
Sot kemi modalitete jofarmakologjike të trajtimit, të cilat përfshijnë para së gjithash; mjekimin kirurgjik të epilepsive, modalitetetet metabolike (dietën ketogjene etj) dhe neurostimulimin.
Mjekimi kirurgjik çon në kontroll të krizave apo ndërprerje të tyre në 50-70% të pacientëve, por kërkon përzgjedhje strikte të pacientëve. Për shkak të frikës së efektit të dëmshëm të krizave epileptike rekurente në trurin e njeriut, tani është aktuale qasja e intevenimit në fazat e hershme të sëmundjes, sidomos te fëmijët me epilepsi fokale dhe tek të rriturit me epilepsi të lobit temporal. Megjithatë duhet cekur se dëshmitë për intervenim kirurgjik të hershëm te epilepsitë, janë të pakta dhe jokomplete. Janë dy kategori të kirurgjisë epileptike; kurative apo intervenime resektive dhe intervenimet kirugjike paliative ose diskonektive të ashtuquajtura.
KIRURGJIA RESEKTIVE
Intervenimet kirugjike resektive të epilepsive mund të jenë temporale ose ekstratemporale. Qëllimi është mënjanimi i suksesshëm i fokusit epileptogjen pa dëmtim të indit trunor të shëndoshë, pra korteksit. Kjo nuk është githmonë e mundshme të bëhet.
Është treguar posaçërisht i suksesshëm mjekimi kirurgjik tek epilepsia e lobit temporal, për të cilën ka shumë studime të bëra (3). Është parë se lobektomia temporale është e sukseshme tek 65% e pacientëve më këtë lloj të epilepsisë, duke arritur ndërrprerjen e plotë të krizave epileptike te këta pacientë. Tek qasja ekstratemoprale, definimi i kufijve të fokusit epileptogjen është më i vështirë, gjë që e bën edhe suksesin më të vogël te këto intervenime. Në një studim, 46% e pacientëve nuk kanë pasur më kriza epileptike pas resekcionit okcipital dhe parietal, ndërsa kjo është arritur tek 27% e pacientëve pas resekcionit frontal të trurit (4).
Llojet e tjera më pak të shpeshta të intervenimeve operative janë korpus kallosotomia dhe transekcionet multiple subpiale. Korpus kallosotomia nënkupton disekcionin e tufave të mëdha të fijeve nervore të cilat i lidhin dy hemisferat e trurit, d.m.th të korpus kallosum. Ndërsa, transekcionet multiple subpiale janë metodë e zgjedhjes te pacientët me zonë të përkufizuar epileptogjene, e cila nuk është e mundur të largohet në mënyrë të sigurt, pa shkaktuar dëmtime të pjesëvë tjera të trurit. Prandaj është zhvilluar kjo metodë operative ku bëhen transekcione me qëllim të shkëputjes dhe ndërprejes së lidhjeve të zonës epileptogjene me regjionet fqinje të trurit, pa i afektuar funksionet për të cilat janë përgjegjëse këto zona.
STIMULIMI I NERVIT VAGUS (VNS)
Stimulimi i nervit vagus është aprovuar si terapi shtesë e krizave epileptike refraktore me fillim fokal, te të rriturit dhe fëmijët mbi moshën 12 vjeçare. Përafërsisht 30-40% e këtyre pacientëve kanë reduktim më të madh se 50 përqind në frekuencën e krizave epileptike dhe ky përmirësim është afatgjatë (5-8). Efektet anësore serioze janë të rralla.
VNS-ja është një opsion relativisht i sigurt dhe valid për ata pacientë të cilët janë me epilepsi refraktore të vërtetuar, të cilët ose nuk janë kandidat për mjekim kirurgjik të epilepsisë ose refuzojnë operimin dhe në fund për ata që nuk kanë pasur përmirësim të dukshëm me intervenimin operativ të mëhershëm.
STIMULIMI KORTIKAL REAGUES (Responsive cortical stimulation)
Është ky opsion i pështatashëm për pacientët me fokus mirë të definuar dhe epilepsi fokale, kur nuk mund të bëhet intervenimi kirurgjik resektiv. Kjo pajisje shfrytëzon njësinë me stimuluesin me qark të mbyllur, bashkëngjitur me njësinë e detektimit të krizave epileptike (9-11). Ngjashëm me VNS-në, edhe stimulimi kortikal reagues ka efekt të vazhdueshëm, duke e rritur me kalimin e kohës efektin kumulativ dhe në këtë mënyrë reduktuar krizat epileptike.
Shumë studime të kontrolluara të vogla, si dhe disa të mëdha, kanë gjetur se stimulimi i hipokampusit ndikon në reduktimin e krizave epileptike te pacientët me epilepsi meziale temporale. Kështu është gjetur në studimet e kontrolluara klinike ku 191 të rritur me epilepsi refraktore fokale janë randomizuar ose për stimulim aktiv në krizat epileptike të detektuara ose për placebo. Pas 12 javësh të terapisë, grupi me stimulim aktiv ka pasur reduktim më të madh krahasuar me grupin placebo (37.9% krahasuar me 17.3%, por numri i pacientëve që kanë pasur reduktim ≥50% në frekuencën e krizave epileptike ka qenë i ngjashëm (29 me 27; ose OR 1.1, 95%CI 0.6-2.1). Te të dy grupet është parë një përmirësim modest i kualitetit të jetës; (nuk kanë pasur impakt negativ ne kognicion dhe disponim). Bazuar në këto rezultate, Autoriteti amerikan i Ushqimit dhe i Barnave (FDA) ka aprovuar këtë pajisje për mjekimin e pacientëve me epilepsi refraktore medikamentoze.
STIMULIMI I THELLË I TRURIT (Deep brain stimulation)
Stimulimi i thellë subkortikal (DBS) ka pasur për cak pjesën e përparme dhe qendroro-mediane të nukleusit talamik, nukleusin subtalamik, nukleusin kaudatus, hipokampusin dhe cerebelumin. Studimet e ndryshme të hapura afatshkurtra dhe ato me placebo të kontrolluara kanë gjetur se stimulimi i pjesëve të sipërpërmendura ka si rezultat reduktimin e krizave epileptike për më shumë se 50% tek disa pacientë, edhe pse jo me domethënie të konsiderueshme statistikore ose klinike në aspektin kohor afatshkurtër.
Në të ashtuquajturin studimin SANTE, i cili ka qenë studim klinik i randomizuar i DBS-së, në nukleusin e përparmë të talamusit, në 110 pacientë me epilepsi refraktore, stimulimi ka treguar 29% reduktim në frekuencën e krizave epileptike, krahasuar me stimulimin placebo në periudhën kohore tremuajshe. Prej tyre 54% e pacientëve kanë pasur reduktim të krizave epileptike për së paku 50% për dy vite me radhë, në fazën jo të verbër të studimit. Përmirësimi më i madh është parë pikërisht te krizat fokale komplekse dhe ato më të “rënda” në kuptimin klinik të fjalës. Në grupin e pacientëve të stimuluar efektet më të shprehura anësore kanë qenë depresioni (15% me 2%) dhe problemet me harresë (13% me 2%). Kanë qenë 5 hemorragji asimptomatikë dhe 14 (13%), infeksione në vendin e vendosjes së implantit.
Në aspektin afatgjatë, te i njëjti studim, d.m.th pas 5 vite, përqindja e pacientëve me rezultat të mirë ka qenë 68% në 59 pacientë, të cilët kanë vazhduar me përcjellje të plotë të krizave epileptike (12). Parametrat e “rëndësisë” dhe kualitetit të jetës janë përmirësuar po ashtu me kalimin e kohës. Nuk janë shënuar efekte anësore të papritura gjatë përcjelljes afatgjatë dhe shkalla e depresionit, vetëvrasjes dhe SUDEP-it (vdekje e papritur) kanë qenë në kufij të parashikuar në popullatën e përgjithshme me epilepsi refraktore (12-13).
Kjo pajisje është aprovuar nga FDA-ja në vitn 2018 si terapi adjuvante për pacientët me epilepsi refraktore ndaj tri ose më tepër terapive antiepileptike. Më parë është aprovuar në Evropë, Kanada dhe Australi.
QASJE TË TJERA STIMULUESE
Mjetet tjera terapeutike nën hulumtim për epilepsi refraktore janë:
- Stimulimi transkranial magnetik – Stimulimi trankranial magnetik me frekuencë të ulët gjithashtu e redukton eksitabilitetin kortikal. Në studimet e kontrolluara dhe rastet e pacientëve, është parë se kjo mund të ndihmojë në reduktimin e frekuencës së krizave epileptike. Megjithatë në studimet mikse të vogla, janë gjetur rezultate te ndryshme (14-17).
- Stimulimi i nervit trigeminal – Një metodë tjetër është stimulimi me frekuencë të ulët i nervit trigeminal nga jashtë (120 Hz), ku është parë reduktim i frekuencës së krizave epileptike te pacientët me epilepsi fokale refraktore medikamentoze. Kjo qasje është aplikuar në studimin e randomizuar, dyfish të verbër, në 50 pacientë me dy ose me tepër kriza fokale në muaj. Brenda periudhës 18 muajshe, sa janë hulumtuar këta pacientë, është parë se stimulimi i jashtëm i nervit trigeminal ka dhënë rezultate më të mira terapeutike (>50 përqind më pak në frekuencën e krizave epileptike ) krahasuar me stimulimin aktiv të grupit kontroll (30% krahasuar me 21 %). Stimulimi i jashtëm i nervit trigeminal gjithashtu ka dhënë edhe përmirësim të disponimit sipas testit të Bekut mbi depresionin. Ky mjet është aprovuar për përdorim në BE dhe ende është duke u hulumtuar në SHBA.
- Dieta ketogjene – Terapia me dietë ketogjene (e pasur me yndryrna – e ulët me karbohidrate) është trajtim efektiv për pacientët me epilepsi, pa marrë parasysh moshën ose llojin e ataqeve epileptike. Është treguar posaçërisht efikase në epilepsitë dhe sindromat e rënda të epilepsive fëmijërore (16,17). Reduktim më të madh se 50% është parë në 38-60% të pacientëve. Problematike është sidomos komplianca afatgjatë e pacientëve.
- Kanabinoidët – Studimet e deritanishme te shtazët dhe raportimet e rasteve të veçanta kanë treguar se kanabinoidët kanë efekt antikonvulsiv, edhe pse edhe ai prokonvulsiv është raportuar.
Por përkundër të dhënave të pamjaftueshme për efikasitet dhe sigurisë së limituar, shfrytëzimi i marihuanës nuk është i pazakontë te pacientët me epilepsi kronike. Në një anketim telefonik të 136 pacientëve me epilepsi, i cili është kryer në një qendër terciare të epilepsisë në Kanada, 21% e pacientëve kanë raportuar përdorimin aktiv të marihuanës; nga këta dy të tretat besonin se marihuana kishte përmirësuar, në kuptim të lehtësimit, krizat e tyre epileptike. Në një studim me shumë variabla, parashikuesit të rëndësishëm të përdorimit të marihuanës ishin frekuenca e sulmeve (≥1 krizë epileptike për muaj), zgjatja më e madhe e sëmundjes dhe përdorimit i narkotikëve të tjerë.
Disa studime të randomizuara kanë treguar efkasitet modest gjatë përdorimit të preparateve të standardizuara të vajit kanbinoid në grupe specifike të pacientëve me epilepsi. (p.sh. sindroma Dravet, sindroma Lennox-Gastaut).
Përveç përdorimit te sindroma Dravet dhe Lennox-Gastaut, të dhënat e besueshme nga studime të kualitetit të lartë janë të limituara. Në vitin 2018, një konsorcium i 25 qendrave epileptike në SHBA ka raportuar rezultatet e një programi me qasje më të gjerë të trajtimit, ku janë furnizuar me terapi adjuvante me vaj kanabinoid 607 fëmijë dhe të rritur me epilepsi rezistente farmakologjike. Reduktimi mesatar në frekuencën e krizave epileptike në javën e 12-të dhe 96-të ishte përafërsisht 50%. Përqindja e terheqjes nga terapia ishte 24%, kryesisht për shkak të mosefikasitetit dhe për shkak të efekteve anësore, ku kryesoret ishin diarrea dhe somnolenca.
Të gjitha këto modalitete jofarmakologjike kanë rezultate premtuese dhe ju nevojiten hulumtime intensive për të arritur vendime të bazuara në mjekësinë e bazuar në evidencë.
EPILEPSIA
Shkruan: Prof. Valbona GovoriFakulteti i Mjekësisë, Universiteti i Prishtinës
Klinika e Neurologjisë, QKUK, SHSKUK
Epilepsia ёshtё njё nga sёmundjet mё tё shpeshta kronike neurologjike nga e cila nё botё janё tё prekur mё shumё se 50 milionë njerёz, e kjo e bёn kёtë njё problem tё rёndёsishёm nё shëndetin publik. Shumica e atyre qё vuajnё nga epilepsia janё viktimё e stigmatizimit nga rrethi/mjedisi, i cili pёr shkak tё panjohurive pёr sёmundjen gabimisht beson se personat me epilepsi janё tё sёmurё mendor dhe se sёmundja e tyre ёshtё sёmundje ngjitёse. Pёr kёtё arsye, personat me epilepsi jo rrallё herё e fshehin sёmundjen nё mёnyrё qё shoqёria tё mos i largojё, gjykojë apo ngacmojë. 85% e tё sёmurёve jetojnë nё vende me tё ardhura tё ulёta dhe mesatare dhe si pasojë e kёsaj ёshtё shёrimi jo adekuat i sёmundjes. Bara e epilepsisë nё ato vende ёshtё dyfish mё e madhe se ato me tё ardhura mё tё larta. Konsekuencat psikosociale tё epilepsisë dhe gjendjes permanente “tё jesh epileptik” janë shpesh problematike se sa prezenca e atakëve. Edhe pse epilepsia nuk ёshtё njё sёmundje e lehtё dhe e padёmshme, ajo mund tё kontrollohet me sukses, dhe falё ilaçeve dhe njё jete tё disiplinuar, me kёtё sёmundje mund tё jetohet njё jetё normale dhe kualitative.
ÇKA JANË SULMET EPILEPTIKE?
Sulmet epileptike janё çrregullime transitore nё funksionin e trurit qё paraqiten si rezultat i zbrazjeve enorme, ekcesive tё qelizave nervore. Ataku epileptik ёshtё manifestim i dukshёm dhe mjaft dramatik pёr rrethin dhe familjarёt. Gjatё ataku mund tё lajmёrohet fiksimi i shikimit, çrregullime tё folurit, ngёrçe tё shkurtra tё njё pjese tё trupit, si dora ose kёmba pengesa nё shqisat e nuhatjes, dёgjimit , mpirje tё shkurtra tё ndonjë pjese tё trupit. Tek tё ashtuquajtura sulme grand-mal mund tё vije deri tek humbja e tërësishme e vetёdijes, ngёrçe nëpër trup, kafshim i gjuhёs, ndёrsa janё tё shpeshta edhe lёndimet gjatё rrёzimit.
Disa fakte mbi epilepsinë
• Nё tё kaluarёn kanё ekzistuar shumё paragjykime dhe dogma pёr epilepsinё. Sot, qёndrimet bashkёkohore tё Ligёs Ndërkomëtare kundёr Epilepsisё tregojnё se personat me epilepsi mund tё jetojnё dhe punojnё normalisht, sikurse çdo individ tjetёr i shëndoshë;
• Kriza epileptike shkaktohet nga zbrazja enorme e eksitimit tё qelizave nervore;
• Një sulm epileptik nuk do tё thotё epilepsi;
• Meshkujt vuajnё pak mё shumё se femrat;
• Epilepsia mund tё fillojё nё çdo moshё por mё e zakonshme ёshtё nё fёmijёri dhe nё moshat e shtyra (mbi 65 vjeç);
• Mund tё paraqitet nё çdo racё dhe çdo shtresё sociale;
• Deri mё 70% e personave me epilepsi kanё kontroll tё plotё tё krizave me pёrdorimin e terapisё antiepileptike;
• Terapia pёr epilepsinё doemos duhet tё merret me rregull, ashtu si ёshtё udhёzuar nga neurologu/epileptologu, me kontrolla të rregullta, si dhe kontrolli i ilaçit nё gjak dhe EEG;
• Ngasja e automjetit kёrkon njё qasje individuale, edhe pse nuk rekomandohet vozitje profesionale. Nё mё shumё vende tё botёs, personave qё s’ kanë pasur sulm nё periudhё prej 1-3 vjet, u lejohet ngasja e automjetit nёn kontroll;
• Shtatzёnia tek femrat me epilepsi duhet tё jetё e planifikuar dhe nё konsultim me epileptologun.
• Personat me epilepsi duhet tё jetojnё dhe tё punojnё nё njё atmosferё normale e tё shёndoshё, me pёrkrahje tё familjes dhe mjedisit shoqёror.
Varёsisht se cila pjesё e sistemit nervor bёhet epileptogjene ashtu do tё jetё edhe çrregullimi funksional, pёrkatёsisht lloji i sulmeve. Kjo nёnkupton se zbrazja patologjike mund tё pёrfshijё qoftё korteksin e tёrёsishёm (korja e trurit) kur kriza do tё gjeneralizohet ose vetёm njё pjesё e korteksit kur kriza do tё jetё e pjesshme (fokale).
SHKAKTARËT E EPILEPSISË
Nё momentin aktual tё njohjes janё tre grupe tё mёdha tё epilepsive:
• Epilepsitë idiopatike (janё nё korrelacion me predispozitёn gjenetike).
• Epilepsitë simptomatike janё tё provokuara nga faktorёt e jashtёm, tё fituar, pёrkatёsisht tё pёrvetёsuar gjatё jetёs: sёmundjet akute infektive, vaskulare, sekuelat e tyre, malformacionet kortikale, tumoreve, lëndimeve traumatike - kontuzioneve trunore, faktorët metabolik etj.
• Epilepsitë kriptogjene (tё fshehta) ekziston shkaku, por ky ёshtё i fshehur pёr njohuritë e deritashme tё kërkimeve diagnostike, neuroradiologjike dhe metabolike.
DIAGNOZA E EPILEPSISË
Një sulm epileptik nuk e vendos diagnozën e epilepsisë. Marrja e historisë së sëmundjes duhet të jetë e detajuar, duke marr në pyetje të sëmurin si dhe personat që e kanë parë sulmin, kjo është çelësi i përcaktimit të diagnozës së epilepsisë.
Ekzaminimi i detajuar neurologjik në shumicën e rasteve rezulton normal. Elektroencefalogrami (EEG) pozitiv është konfirmim i dobishëm për diagnozën e epilepsisë. Ekzaminimi i gjakut tregon gjendjen e përgjithshme të pacientit, ndihmon në zbulimin e shkaqeve metabolike, elektrolitike.
Rezonanca Magnetike e kokës, ekzaminim imazherik mjaft i rëndësishëm dhe i dobishëm në përcaktimin e shkaktarëve të mundshëm të epilepsisë.
TRAJTIMI I EPILEPSISË
Epilepsia është një sëmundje që mund të trajtohet, për dallim nga botëkuptimi i mëhershëm se për të sëmurët nga epilepsia është normale që të kenë sulme, qasja bashkëkohore në mjekimin e epilepsisë nënkupton kontroll të plotë të sulmeve, me efekte të padëshirueshme minimale. Kjo është bërë e mundur në saje të përdorimit të antiepileptikëve të gjeneratës së re. Afër 70% të personave me epilepsi nuk do të kenë sulme nëse marrin ilaçin e vërtetë. Barnat antiepileptike (AE-të) ndikojnë asisoj që pengojnë paraqitjen e serishme të sulmeve.
Përcaktimi i diagnozës dhe marrja e vendimit për fillimin e terapisë antiepileptike duhet të bëhet nga ana e mjekut specialist neurolog epileptolog.
Fillimi me terapi antiepileptike rekomandohet pasi të kenë ndodhur dy atakë të “paprovokuar”, respektivisht, në disa raste, pas atakut të parë, nëse ekzistojnë ndryshime të theksuara në EEG. Rekomandohet fillimi i trajtimit me një medikament (monoterapi).
Zgjedhja e antiepileptikut bëhet pasi që mjeku ka përcaktuar formën e epilepsisë, ka njohuri mbi efektet farmakokinetike dhe ato farmakodinamike të antiepileptikut, si dhe efektet anësore të tij.
Nëse nevojitet ndërrimi i ilaçit, kjo duhet të bëhet në mënyrë graduale. Po që se personi vazhdon të ketë sulme edhe përkundër faktit se ka marrë tri lloje të AE-ve, duhet të bëhet konfirmimi i diagnozës.
Tek disa persona, kontrolli i sulmeve nuk mund të arrihet me një ilaç, por është e nevojshme që të kombinohen dy ose më shumë ilaçe. Marrja e një e më shumë ilaçeve përnjëherë quhet politerapia.
Në trajtimin e epilepsisë janë të nevojshme kontrolle të rregullta, ilaçet duhet të merren rregullisht dhe me kohë siç janë shkruar nga ana e mjekut specialist dhe assesi nuk duhet të ndërpriten në mënyrë të menjëhershme (kjo mund të sjell deri tek paraqitja e serishme ose shpeshtim të atakëve) ose të ndryshohet doza e medikamentit pa u konsultuar mjeku.
Çdo ilaç mund të shkaktojë veprime të padëshiruara. Paraqitja e veprimeve të padëshiruara është shumë individuale dhe dallohet prej një njeriu tek tjetri.
Disa persona mund të reagojnë me reaksion alergjik, i cili në raste të rralla mund të jetë mjaft serioz. Rëndom shenja e parë për reaksion alergjik janë skuqjet në lëkurë që paraqiten shumë shpejt pas fillimit të terapisë. Një skuqje e këtillë duhet urgjentisht të paraqitet te mjeku.
Ndërprerja e mjekimit mund të mendohet pas një periudhe 3-5 vjeçare pa asnjë krizë epileptike (duke shqyrtuar çdo pacient në mënyrë të veçantë).
Tek rastet rezistente në terapi (rreth 20%), përkundër kombinimit të disa antiepileptikëve, atakëve epileptik janë frekuente, mund të mendohet për trajtim neurokirurgjik, largimin e plotë të vatrës epileptike, që kryhet vetëm në qendra të specializuara.
KOKËDHEMBJET PRIMARE
Kokëdhembja është një nga arsyet më të zakonshme që pacientët kërkojnë kujdes mjekësor në baza globale, duke qenë përgjegjëse për më shumë paaftësi se çdo problem tjetër neurologjik.
Diagnoza dhe menaxhimi i kokëdhembjes bazohen në një kujdes dhe qasje klinike të bazuar në kuptimin e anatomisë, fiziologjisë dhe farmakologjisë së sistemit nervor dhe rrugëve nervore që ndërmjetësojnë sindromat e ndryshme të kokëdhembjes.
ANATOMIA DHE FIZIOLOGJIA E DHIMBJES
Dhimbja zakonisht shfaqet kur nociceptorët periferikë stimulohen në përgjigje të dëmtimit të indeve, distensionit visceral,ose nga shkaktarët tjerë. Në situata të tilla, perceptimi i dhimbjes është një përgjigje normale fiziologjike e ndërmjetësuar nga një sistem nervor i shëndetshëm. Dhimbja mund të rezultojë edhe kur rrugët që prodhojnë dhimbje përgjatë sistemit nervor qendror apo periferik dëmtohen apo aktivizohen në mënyrë të papërshtatshme. Strukturat e kafkës si lëkura e kokës, arteria meningjeale e mesme, sinuset durale, falx cerebri dhe segmentet proksimale të arterieve piale mund të shkaktojnë kokëdhembje gjithashtu. Ependima ventrikulare,pleksusi koroid, venat piale dhe një pjesë e madhe e parenkimës trunore nuk shkaktojnë dhimbje.
Strukturat kryesore të përfshira në kokëdhembjen primare janë:
• Enët e mëdha intrakraniale, dura mater dhe pjesët terminale të nervit trigeminal që inervojnë këto struktura;
• Pjesa kaudale e bërthamës trigeminale, e cila shtrihet në brirët dorzal të palcës kurrizore të sipërme cervikale dhe merr të dhënat ngarrënjët të nervit cervikal të parë dhe të dytë (kompleksi trigemino-cervikal);
• Regjionet rostrale që përpunojnë dhimbjen, si talamusi ventroposteromedial dhe korteksi;
• Sistemet moduluese të dhimbjes në tru që modulojnë të dhëna nga nociceptorët trigeminal në të gjitha nivelet e rrugëve të përpunimit të dhimbjes dhe influencojnë funksionet vegjetative, të tilla si hipotalamusi dhe strukturat e trungu trunor.
Inervimi i enëve të mëdha intrakraniale dhe dura mater nga nervi trigeminal njihet si sistemi trigeminovaskular. Simptomat autonome kraniale, të tilla si lotimi, injektimi konjuktival, kongjestion i hundës, rinorrhea, ënjtje periorbitale dhe ptoza janë të shpeshta në cefalalgjitë autonome trigeminale, duke përfshirë kokëdhembjen cluster dhe hemikraninë paroksizmale, e madje edhe në migrenë. Këto simptoma autonome pasqyrojnë aktivizimin e rrugëve parasimpatike kraniale. Imazheritë funksionale tregojnë se ndryshimet vaskulare në migrenë dhe kokëdhembjen cluster, kur janë të pranishme, janë të nxitura në mënyrë të ngjashme me këto sisteme autonome kraniale.
KOKËDHEMBJA E TIPIT TENSIONAL
Pothuajse të gjithë kanë një kokëdhembje në një kohë kur janë të stresuar, të mbingarkuar, të shqetësuar, ose janë subjekt i tendosjes së zgjatur të muskujve. Kokëdhembja e tillë largohet me shpejtësi me relaksim, gjumë ose përdorim të analgjezikëve. Historikisht kokëdhembja e tipit tension i është atribuar tkurrjes së vazhdueshme të muskulaturës së kokës, qafës dhe nofullës. Megjithatë, koncepti i tkurrjes së muskujve që shkakton kokëdhembje është vënë në pikëpyetje. Prevalenca e kokëdhembjes së tipit tension ndryshon në popullatën e përgjithshme nga 30% në 78%.
Kokëdhembja e tipit tension mund të fillojë në çdo moshë, është e dyanshme dhe shpesh përshkruhet si një ndjenjë presioni ose vendosje e një shiriti të ngushtë rreth kokës. Kokëdhembja është me intensitet të lehtë deri në mesatar, me tendencë të mos përkeqësohet nga aktiviteti fizik dhe mund të zbehet gjatë ditës ose mund të jetë i pranishëm dhe i qëndrueshëm për ditë, javë, apo edhe vite. Kokëdhembja e tipit tension nuk përcillet me mundim ose të vjella dhe është shumë më rrallë e lidhur me ndjeshmërinë ndaj dritës dhe zërit sesa migrena.
Patofiziologjia e kokëdhembjes së tipit tension është joplotësisht e kuptuar. Teoria se tensioni emocional çon në tension të muskujve dhe më pas në kokëdhembje të tipit tension është shumë e thjeshtë. Një mekanizëm shumë më kompleks duhet të jetë përgjegjës për dhimbjen, që ka të ngjarë të përfshijë ndërveprim ndërmjet të dhënave në miofasciet periferike dhe sensibilizimit të neuroneve nociceptive në bërthamën trigeminale dhe bririn dorsal të palcës kurrizore. Nëse dhimbja e kokës është e re ose përkeqësohet në mënyrë progresive, një CT ose MRI e trurit mund të ndihmojë në përjashtimin e sëmundjeve serioze strukturore intrakraniale që imitojnë kokëdhembjen e tipit të tensionit.
Për kokëdhembjet e lehta të tipit tension, aspirina, acetaminofeni ose NSAID mund të jenë të mjaftueshme. Kombinimi i acetaminofenit me izomethepten dhe dikloralfenazon mund të jetë i dobishëm për kokëdhembje mesatarisht të forta. Ilaçi profilaktik më efektiv është ndoshta amitriptilina në trajtimin e kokëdhembjes të tipit të tensionit. Amitriptilina tolerohet më mire nëse jepet si një dozë e vetme para gjumit. Antidepresantë të tjerë triciklikë, gabapentin, mirtazapin, valproat natriumi ose topiramat mund të përdoren si profilaktikë nëse amitriptilina nuk tolerohet ose është e kundërindikuar.Teknika për të nxitur relaksimin e muskujve të kokës dhe qafës (p.sh., biofeedback, masazh i qafës) mund të ndihmojnë trajtimin afatshkurtër, por përfitimi afatgjatë nuk është vërtetuar.
KOKËDHEMBJET AUTONOME TRIGEMINALE
Kokëdhembjet autonome trigeminale përfshijnë një grup të kokëdhembjeve parësore si: kokëdhembja cluster, hemikrania paroksizmale, SUNC/SUNA dhe hemikrania e vazhdueshme. Kokëdhembjet autonome trigeminale karakterizohen nga sulme relativisht afatshkurtra të kokëdhembjes, të shoqëruara simptomat autonome kraniale, të tilla si lotimi, injektimi konjuktival, ose kongjestion nazal. Dhimbja është zakonisht e fortë dhe mund të përsëritet më shumë se një herë në ditë. Për shkak të kongjestionit të hundës ose rinorresë, pacientët diagnostikohen gabimisht me kokëdhembje nga sinusiti dhe trajtohen në mënyrë jo efektive me dekongjestantë. Këto kokëdhembje duhet të diferencohen nga kokëdhembjet afatshkurtra që nuk kanë simptoma të theksuara autonome kraniale.
Përsëritja, gjatësia, frekuenca dhe koha e sulmeve janë faktorë të rëndësishëm në diagnostikimin e pacientëve. Pacientët duhet të ju nënshtrohen testimeve imazherike të hipofizës dhe funksionit të hipofizës, sepse një numër i madh i pacientëve me kokëdhembje nga tumori i hipofizës prezantojnë si kokëdhembje autonome trigeminale.
KOKËDHEMBJA CLUSTER
Kokëdhembja cluster është padyshim kokëdhembja më e dhimbshme dhe ajo që prodhon sulmet më stereotipike. Në kokëdhembjen cluster episodike, sulmet e dhimbjes ndodhin në periudha që zgjasin 7 ditë deri në një vit, të ndara meperiudha pa dhimbje që zgjasin tre muaj ose më shumë.Në kokëdhembjen kronike cluster, sulmet e dhimbjes ndodhin për më shumë se një vit pa remision ose me remisione që zgjasin më pak se tre muaj. Kjo formë kronike e sëmundjes mund të zhvillohet de novo ose mund të evoluojë nga kokëdhembja episodike cluster. Përafërsisht 90% e pacientëve kanë kokëdhembje episodike cluster dhe 10% e pacientëve kanë kokëdhembje kronike cluster.
Epidemiologjia
Krahasuar me kokëdhembjen e tipit tensioni dhe migrenën, kokëdhembja cluster është dukshëm më e rrallë. Në shumë klinika për kokëdhembje migrena është 10-50 herë më e zakonshme se kokëdhembja cluster. Prevalenca e kokëdhembjes cluster është rreth 1 në 500 persona. Ajo shfaqet përafërsisht tre herë më shpesh te meshkujt sesa te femrat, por është klinikisht identike në të dyja gjinitë. Ndryshe nga migrena, kokëdhembja cluster nuk është konsideruar deri vonë si një gjendje e trashëguar.Disa studimet në binjak kanë treguar përputhshmëri 100% në binjakët monozigotikë. Dy anketa epidemiologjike gjenetike sugjerojnë që të afërmit e shkallës së parë mund të kenë një rrezik deri në 18 herë më të lartë dhe të afërmit e shkallës së dytëkanë një rrezik 1 deri në 3 herë më të lartë për kokëdhembje clusterse sa popullata e përgjithshme. Trashëgimia ka të ngjarë të jetë autozomale dominanteme penetrim të ndryshueshëm; megjithatë, në disa familje mund të jetë autosomale recesive ose multifaktoriale.
Karakteristikat klinike
Kokëdhembja zakonisht fillon në dekadën e tretë të jetës, megjithëse janë raportuar raste që në moshën një vjeçare dhe deri në dekadën e shtatë. Periodiciteti është një tipar kryesor i kokëdhembjes cluster. Kohëzgjatja e kokëdhembjes cluster është shpesh jashtëzakonisht e qëndrueshme për një pacient të caktuar. Një model i zakonshëm është një ose dy kokëdhembje cluster në vit. Megjithatë, me kalimin e kohës kokëdhembjet mund të bëhen sezonale dhe më pas të përsëriten më shpesh dhe të zgjasin më shumë. Është i zakonshëm fillimi gjatë natës ose 1-2 orë pas rënies në gjumë. Në disa pacientë kjo mund të ndodhë në fillimin e gjumit me lëvizje të shpejtë të syve (REM). Ndonjëherë disa sulme për natë mund të rezultojnë në mungesën e gjumit në pacientët me kokëdhembje kronike cluster, veçanërishtkur pacientët shmangin gjumin nga frika se mos shkaktojnë një sulm tjetër. Kokëdhembja është rreptësisht e njëanshme dhe pothuajse gjithmonë mbetet në të njëjtën anë të kokës në grup. Rrallëherë mund të kalojë në të kundërtën anë në një cluster të mëvonshëm ose edhe (më rrallë) gjatë një sulmi të vetëm. Kokëdhembja në përgjithësi ndihet në regjionet retro-orbitale dhe temporale (sindroma e sipërme) por mund të jenë maksimale në faqe ose nofulla (sindroma e poshtme). Kokëdhembja përshkruhet si e qëndrueshme ose e mërzitshme dhe me intensitet të tmerrshëm (e ashtuquajtura kokëdhembje vetëvrasëse). Fillimi është zakonisht i papritur ose i paraprirë nga një ndjesi e shkurtër presioninë zonën që së shpejti do të jetë e dhimbshme. Dhimbja intensifikohet shumë shpejt, duke arritur kulminacionin në 5-10 minuta dhe zakonisht vazhdon për 45 minuta deri në 2 orë. Pas sulmit, pacienti është pa dhimbje por i rraskapitur; megjithatë, pushimi mund të jetë kalimtar sepse një tjetër sulm mund të ndodhë shpejtë.
Gjatë kokëdhembjes cluster, vrima e hundës në anën e kokëdhembjes në përgjithësi është e bllokuar. Ky bllokim mund të pasohet nga lotim i njëanshëm dhe arteria temporale sipërfaqësore mund të jetë dukshëm e zgjeruar. Djersitja e madhedhe skuqja e fytyrës në anën e kokëdhembjes janë përshkruar por janë të rralla. Rinorrea zakonisht sinjalizon fundin e sulmit. Ptoza dhe mioza mund të ndodhë në anën e kokëdhembjes. Kjo sindromë Horner mund të vazhdojë midis sulmeve dhe besohet se është për shkak të kompresionit të pleksusit simpatik nga vazodilatimit ose ndryshimet tjeranë regjionin e sifonit karotid. Shumica e pacientëve janë duhanpirës dhe priren të përdorin më shumë alkoolse sa subjektet e kontrollit.
Patofiziologjia
Patogjeneza e kokëdhembjes cluster nuk është kuptuar plotësisht. Derisa kokëdhembja ka të ngjarë të ndërmjetësohet nga aktivizimi i rrugëve të nervit trigeminal, simptomat autonome shfaqen për shkak të rrugëve parasimpatike dhe mosfunksionimit të atyre simpatike. Periodiciteti sugjeron një defekt në sistemin nervor qendror që ka të ngjarë të lidhet me mosfunksionimin hipotalamik. Evidenca më e drejtpërdrejtë në mbështetje të rolit të hipotalamusit në kokëdhembjen cluster vjen nga neuroimazheria. Studimet imazherike PET kanë treguar aktivizim në diencefalonin ventral ipsilateral gjatë kokëdhembjeve cluster të nxitura nga nitroglicerina. Përveç kësaj, një studim morfometrik i imazheve të MRI ka treguar një rritje të vëllimit në diencefalon.
Në 1993, Moskowitz theksoi rolin e lidhjeve trigemino-vaskulare dhe substancës P në patogjenezën e kokëdhembjeve vaskulare. Prova të mëtejshme sugjeruan aktivizimin e sistemit trigeminovaskular siç manifestohet nga nivelet e rritura të CGRP në gjakun e marrë ngavena jugulare e jashtme ipsilaterale me një sulm akut spontan të kokëdhembjes cluster. Aktivizimi parasimpatik besohet të jetë përgjegjës edhe për injektim konjuktival, lotim, kongjestionin nazal, rinorrenë dhe/ose edemën e qepallave. Mbiaktiviteti trigeminal-parasimpatik mund të rezultojë në edemë perivaskulare që komprimeton kanalin karotid, duke çuar deri te dëmtimi i fibrave simpatike postganglionike dhe si rrjedhojë një sindromë Horner e manifestuar në ptozë dhe miozë. Fakti që stimulimi me frekuencë të ulët i ganglionit sfenopalatine (SPG) mund të provokojë kokëdhembje të ngjashme me ato cluster me veçori autonome sugjeron se rrugët eferente parasimpatike nga ky ganglion mund të shkaktojnë simptomat autonome dhe aktivizim të rrugëve aferente trigemino-vaskulare përgjegjëse për dhimbjen.
Hulumtimet
Në shumicën e pacientëve, diagnoza është e sigurt vetëm në baza klinike. Megjithatë, studimet imazherike rekomandohen për të gjithë pacientët që nga koha e diagnozës, veçanërisht për ato kokëdhembje atipike. Kokëdhembje të ngjashme me ato cluster mund të shfaqen edhe tek lezionet strukturore intrakraniale ose të qafës, të tilla si neoplazitë, sëmundja e sinusit paranazal, keqformimet vaskulare dhe cervikocefalike dhe aneurizmat ose diseksionet arteriale. Prandaj, MRI rekomandohet për qetësimin e pacientit, të afërmve të tyre dhe mjekët se sulmet jashtëzakonisht të dhimbshme nuk janë për shkakte ndonjë anomalie të madhe. Gjykimi klinik vlerëson domosdoshmërinë për hulumtime të mëtejshme.
Diagnoza diferenciale
Diagnoza e kokëdhembjes cluster është diagnozë klinike. Është i rëndësishëm konfirmimi nga familjarët për periodicitetin, shpejtësinë e fillimit dhe përfundimit të kokëdhembjes dhe prania e injeksionit konjuktival, rinorres, ptozës dhe sjelljeve të ndryshuara gjatë sulmit. Pavarësisht natyrës stereotipike të sulmeve nga episodi në episod dhe nga pacienti në pacient, diagnoza shpesh nuk bëhet për disa vite. Gjendjet që shkaktojnë dhimbje episodike të njëanshme të kokës dhe fytyrës që duhet të merren parasysh janë:
- Neuralgjia trigeminale
- Sinusiti
- Sëmundjet e dhëmbëve
- Glaukoma
- Migrena
- Arteriti temporal
- Kokëdhembja nga lezionet intrakraniale
- Sindroma Horner
- Sindroma Tolosa-Hunt
- Sindroma paratrigeminale Raeder
Trajtimi dhe menaxhimi
Pacienti duhet të sigurohet se sindroma, edhe pse e dhimbshme dhe e padurueshme, është beninje dhe jo kërcënuese për jetën. Duhet premtuar reduktimi i dhimbjes por jo dhe shërimin.
Frekuenca, ashpërsia dhe kohëzgjatja e sulmeve individuale të kokëdhembjeve cluster dhe mungesa e përgjigjes së tyre ndaj shumë masave kërkon trajtim profilaktik për shumicën e pacientëve. Plani i trajtimit përcaktohet nga disa faktorë, duke përfshirë nëse kokëdhembja është episodike apo kronike dhe nëse pacienti vuan nga sëmundje tjetër kronike të tillë si hipertensioni dhe insuficienca vaskulare koronare apo periferike.
Trajtimi farmakologjik
Trajtimi akut simptomatik
- Oksigjen terapia
- Sumatriptani subkutan
- Dihidtroergotamina subkutane ose intramuskulare
Profilaksa tranzicionale
- Kortikosteroidet
- Ergotamina
- Dihidroergotamina
Profilaksa mbajtëse
- Kortikosteroidet
- Bllokatorët e kanaleve të kalciumit
- Litium karbonati
- Antitrupat monoklonal
- Terapi adjuvante: Melatonina, Baklofeni, Civamide intranazale
Trajtimi kirurgjik
- Termorregullimi me radiofrekuencë i ganglionit gaserian
- Rizotomia sensorike trigeminale
- Dekompresioni mikrovaskular in nervit trigeminal
- Ablacioni me radiofrekuencë i ganglionit sfenopalatin
- Implantimi sterotaktik i elektrodës stimuluese në hipotalamusin periventrikular
- Stimulimi periferik i nervit okcipital
HEMIKRANIA PAROKSIZMALE
Hemikrania paroksizmale (HP) ka një fillim tipik në dekadën e tretë të jetës dhe raporti femra-meshkuj është afërsisht 1:1. HP kronike dhe HP episodike ndryshojnë në profilin e tyre kohor. Në HP kronike, sulmet ndodhin për më shumë se një vit pa remision ose me periudha remisioni që zgjasin më pak se 3 muaj. HP episodike karakterizohet nga periudha të sulmeve që zgjasin nga 7 ditë deri në 1 vit dhe të ndara nga periudha të remisionit që zgjasin të paktën 3 muaj. Kokëdhembja mund të ndryshojë nga 4 deri në 24 javë dhe periudhat e remisionit mund të zgjasin 12-376 javë. Ndërsa janë aktive, të dyja çrregullimet shoqërohen me sulme të përditshme kokëdhembjes së fortë të njëanshme jetë shkurtër, e cila ndihet maksimalisht në regjionin orbital/retro-orbital ose temporal, edhe pse ekstra-trigeminalmund të ndodhë dhimbje në zverku.
Ngjashëm me kokëdhembjen cluster, HP shoqërohet me të paktën një tipar autonom ipsilateral, i cili mund të jetë lotim, miozë, ptozë, edemë e qepallave, injektim konjuktival, kongjestion nazal, rinorre ose djersitje në ballë apo fytyrë. HP në mënyrë tipikei përgjigjet plotësisht indometacinës. Në njëpacient me HP të dyshimtë, prova e zakonshme e indometacinës realizohet me indometacinë 25 mg 3 herë në ditë për 3 ditë, pastaj 50 mg 3 herë në ditë për 3 ditë, dhe më pas 75 mg 3 herë në ditë për 3 ditë. Nëse në fund të kësaj prove ka përgjigje minimale ose asnjë përgjigje, ndërpritet indometacina dhe konsideroni një diagnozë alternative. Nëse ka një përgjigje absolutenë provën e indometacinës, trajtimi vazhdohet për aq kohë që tolerohet. Dhimbja e kokës zakonisht largohet brenda 1-2 ditështë fillimit të dozës efektive. Përgjigja terapeutike ndaj indometacinës është kriteri më i besueshëm diagnostikues diferencial për kokëdhembje cluster dhe HP. Trajtime të tjera që raportohen të jenë efektive në HP përfshijnë: celecoxib, rofecoxib, toksina botulinium A, verapamil, nikardipina, flunarizina, ibuprofeni, ketoprofeni, aspirina, piroksikami, naproksen, diklofenak, fenilbutazon, acetazolamid, topiramat, prednizon, litium, ergotaminë, sumatriptan, oksigjen, bllokimi i nervit okcipital, stimulimi i nervit okcipital dhe stimulimi hipotalamik.
SULMET AFATSHKURTRA TË NJËANSHME TË KOKËDHEMBJES NEURALGJIFORME (SUNCT/SUNA)
Sulmet afatshkurtra të njëanshme të kokëdhembjes neuralgjiforme janë sulme të kokëdhembjes të moderuara ose të rënda, të njëanshme, që zgjat nga disa sekonda deri në disa minuta, që ndodhin të paktën një herë në ditë dhe zakonisht shoqërohen me lotim të theksuar dhe skuqje të syrit ipsilateral. Ky çrregullim ka dy fenotipe klinike. Kur sulmet shoqërohen me injektim konjuktival dhe lotim, atëherë quhen SUNCT (kokëdhembje neuralgjiforme e njëanshme afatshkurtër me injektim konjuktival dhe lotim). Kur vetëm njëra ose kur as injektimi konjuktival as lotimi nuk është i pranishëm, atëhere quhet SUNA (kokëdhembje neuralgjiforme e njëanshme afatshkurtër me simptoma autonome kraniale). SUNCT dhe SUNA janë çrregullime të rralla dhe trajtimi i tyre është tërësisht profilaktik, në përgjithësi duke përdorur të njëjtat medikamente. Sulmet e dhimbshme të SUNCT zakonisht ndihen brenda ose rreth syrit dhe ndonjëherë mund të nxiten nga stimulimi i lëkurës. Sulmet mund të ndodhin 2-600 herënë ditë, me një mesatare prej 59 sulmesh në ditë.
Lamotrigina ka qenë efektive në disa pacientë. Topiramati, karbamazepina dhe gabapentina janë të gjitha alternativa të arsyeshme për t'u marrë parasysh. Opsione të tjera më të pakontrolluara përfshijnë okskarbazepinë, verapamil, klomifen, zonisamid, onabotulinum toksina A, kortikosteroidet dhe lidokaina IV. Trajtime të tjera efektive në SUNCT përfshijnë bllokimin e nervit okcipital, bllokimin opioid të ganglion cervikal superior, stimulim hipotalamik dhe heqja e mikroadenomës së hipofizës.
Të dy SUNCT dhe SUNA janë raportuar se i përgjigjen dekompresimi mikrovaskular të nervit trigeminal.
HEMIKRANIA E VAZHDUESHME
Siç nënkupton edhe emri, hemikrania e vazhdueshme karakterizohet nga një kokëdhembje në vazhdimësi, e njëanshme, me intensitet mesatar, që mund të përfshijëtë gjithë hemikraniumin ose thjesht të kufizohen në një zonë fokale. Raporti femra-meshkuj është afërsisht 2:1 dhe mosha mesatare e fillimit është 28 vjeç vjet (5–67 vjeç). Edhe pse i vazhdueshëm, ky çrregullimndonjëherë mund të ngjajë me një sulm të zgjatur të njëanshëm të migrenëszgjat disa ditë deri në disa javë dhe me periudha remisioni. Kokëdhembja zakonisht shoqërohet me acarime të njëanshme të kokëdhembjes zgjat nga 20 minuta deri në disa ditë. Këto periudha të rritjes intensiteti të dhimbjes shoqërohen nga një ose më shumë veçori autonome.Kokëdhembja primare therëse ("kokëdhembja icepick") ipsilaterale gjatë një periudhe ekzacerbimi është shpesh një tipar i këtij çrregullimi.
Pacientët me hemikrani të vazhdueshme i përgjigjen plotësisht indometacinës profilaktike. Sidoqoftë,rreth një e katërta e pacientëve nuk e tolerojnë indometacinën për shkak të efekteve anësore gastrointestinale. Përgjigje e plotë ndaj rofekoksibit, celekoksibit, aspirinës, naproksenit,ibuprofeni, diklofenaku dhe piroksikami në hemikrania të vazhdueshme është raportuar. Dihydroergotamine, methysergide, kortikosteroidet, acemetacina, acetaminofen me kafeinë, lamotrigine, gabapentin,topiramat, melatonin, acid valproik, verapamil, onabotulinum toksinaA, dhe litiumi janë raportuar të jetë efektiv në disa raste. Të tjera trajtime përfshijnë bllokun e nervit okcipital ose supraorbital dhe stimulimin e nervit okcipital.
KOKËDHEMBJA PRIMARE NGA KOLLITJA
Kokëdhembja primare nga kollitja është një kokëdhembje me fillim të papritur që precipitohet nganjë manovër e shkurtër dhe e paqëndrueshme e Valsalvës si kollitja, e qeshura, teshtitja, ose përkulja. Kokëdhembja është zakonisht e dyanshme, shpërthyese dhe zgjat nga disa sekonda në disa minuta. Si rregull, pacienti është i lirë nga kokëdhembja ndërmjet sulmeve. Mosha mesatare e pacientëve në fillim të kokëdhembjes primare nga kollitja është rreth 60 vjet. Proporcioni i pacientëve që kanë një shkaktar strukturor themelor ka ndryshuar ndërmjet 11% dhe 59% në studimet e bëra në epokën e MRI. Keqformimi Chiari i tipit I është anomalia strukturore më e zakonshme e gjetur në imazhe,por janë përshkruar entitete të tjera, si dhimbja e kokës dytësore nga rrjedhja spontane e lëngut cerebrospinal në shtyllën kurrizore, tumoret e trurit të mesëm ose fosës posteriore, metastazat e trurit, tumoret e hipofizës, cistet araknoidale të fosës posteriore, impresioni basilar, sinusiti sfenoid, hematoma subdurale, RCVS, dhe ndoshta aneurizma intrakraniale e parupturuar dhe stenoza karotide.
Trajtimi i zgjedhur është indometacina, e administruar në një regjimtë ngjashme me atë të përshkruar për PH. Sidoqoftë, përgjigja ndaj indometacinësnuk konfirmon një etiologji beninje.
KOKËDHEMBJA PRIMARE NGA USHTRIMET FIZIKE
Kokëdhembja primare nga ushtrimet fizike (e quajtur më parë kokëdhembja primare sforcuese) është një kokëdhembje pulsuese e dyanshme, që precipitohet nga ushtrimet e zgjatura fizike. ICHD-3 I diferencon ushtrimet fizike me këtë lloj kokëdhembjes më shumë si një përpjekje të vazhdueshme sesa një shpërthim të shkurtër përpjekjesh që mund të shkaktojë kokëdhembjen primare nga ushtrimet fizike. Kokëdhembja nuk është shpërthyese në fillim, por përkundrazi ndërtohet në intensitet dhe zgjatë prej 5 minuta deri në 48 orë. Dhimbja e kokës mund të parandalohet duke shmangur sforcimin e tepruar, veçanërisht në mot të nxehtë ose në lartësi të madhe. Ngjashëm me kokëdhembjen nga kollitja, ky çrregullim mund të jetë beninj ose simptomatik i një sëmundjeje tjetër parësore. Shkaqet e dhimbjes dytësore të kokës përfshijnë hemorragjinë subaraknoidale, metastazat cerebrale, hipertensioni intrakranial, pansinusiti, dhe feokromocitoma. Dhimbja iskemike kardiake e shkaktuar nga stërvitja mund të i referohet kokës dhe qafës dhe njihet si cefalalgjia kardiake. Trajtim parandalues me beta-bllokatorë ose indometacinë është efektive në disa pacientë me kokëdhembje primare nga ushtrimet fizike. Terapia profilaktike ndaj migrenës mund të jetë efektive. Ergotamina ose indometacina profilaktike para ushtrimeve fizike mund të jenë efektive.
KOKËDHEMBJA PRIMARE E LIDHUR ME AKTIVITETIN SEKSUAL
Kokëdhembja e shkaktuar nga aktiviteti seksual mund të shfaqet si kokëdhembje e dyanshme, intensiteti i së cilës rritet gradualisht me eksitimin seksual (më parë e quajtur kokëdhembje preorgazmike) ose një kokëdhembje të papritur eksplosive në orgazmë (më parë e quajtur kokëdhembje orgazmike) dhe me disa pacientë që përjetojnë të dyja. Kokëdhembja është zakonisht e dyanshme dhe me një kohëzgjatje mesatare prej 30 minutash (dhimbja e fortë mund të zgjasë nga 1 minutë deri në 24 orë). Mosha e shfaqjes së kokëdhembjes ndryshon nga dekada e dytë në atë të katërt dhe ka një predominim të qartë te meshkujt. Kokëdhembjet simptomatike të shkaktuara nga aktiviteti seksual ndajnë të njëjtën gjë diferenciale me shkaqet dytësore të kokëdhembjeve të shkaktuara nga ushtrimet fizike. Në veçanti është e rëndësishme të përjashtohet hemorragjia subaraknoidale, diseksioni arterial, feokromocitoma dhe RCVS.
Përafërsisht 50% e pacientëve mund të lehtësojnë kokëdhembjen duke marrë një rol më pasiv gjatë aktivitetit seksual. Indometacina (25-50 mg) e dhënë 30-60 minuta para aktivitetit seksual mund të parandalojë kokëdhembjen. Për ata që nuk tolerojnë ose nuk reagojnë ndaj indometacinës, mund të merret një triptan oral 30-45 minuta para aktivitetit seksual. Propranololi, metoprololi, ose diltiazem mund të jetë efektiv për pacientët me kokëdhembje të shpeshta.
KOKËDHEMBJA PRIMARE ‘THUNDERCLAP-RRUFE’
Kokëdhembja primare ‘thunderclap-rrufe’ është një kokëdhembje e fortë që arrin intensitetin maksimal në më pak se 1 minutë. Është shpejtësia me të cilën dhimbja e kokës arrin intensitetin maksimal që e diferencon nga llojet e tjera të dhimbjes së kokës. Ka shumë shkaktarë të këtij lloji të kokëdhembjes, duke përfshirë por pa u kufizuar në hemorragjinë subaraknoidale, rrjedhjen spontane të lëngut cerebrospinal të shtyllës kurrizore, RCVS, diseksionin e arteries cervikale, trombozën e sinuseve venoze cerebrale, feokromocitomën dhe krizën hipertensive. Kur nuk identifikohet shkaku themelor për kokëdhembjen ‘thunderclap-rrufe’ pas një vlerësimi gjithëpërfshirës, atëherë konsiderohet diagnoza e kokëdhembjes primare.
KOKËDHEMBJA NGA STIMULI I FTOHTË
Kokëdhembja nga stimuli i ftohtë është një kokëdhembje e përgjithësuar që pason ekspoziminndaj një stimuli të ftohtë që ose aplikohet nga jashtë ose gëlltitet. Për shembull, kjo mund të përfshijë ekspozimin ndaj motit të ftohtë, zhytjen në ujë të ftohtë, ose duke kaluar një material të ftohtë të ngurtë ose të lëngshëm mbi qiellzën ose faringun e pasmë (e njohur më parë si kokëdhembje nga akullorja). Patofiziologjia e kokëdhembjes nga stimuli i ftohtë nuk është kuptuar plotësisht. Klinikisht, pas ekspozimit ndaj stimulit të ftohtë,dhimbja fillon brenda sekondave, arrin intensitetin pas 20-60 sekondave dhepastaj ulet brenda 10 minutave pas largimit të stimulit të ftohtë. Lokacioni i kokëdhembjes është më së shpeshti në regjionin frontal, bitemporal ose okcipital. Ky lloj i kokëdhembjes parandalohet duke shmangur stimulin e njohur.
KOKËDHEMBJA NGA PRESIONI I JASHTËM
Kokëdhembja nga presioni i jashtëm i referohet kokëdhembjes që vjen nga ngjeshja ose tërheqja e lëkurëse së kokës, pa dëmtim aktual të indit lëkuror. Kokëdhembja zakonisht shfaqet brenda një ore pas ekspozimit ndaj stimulit dhe largohet brenda një ore pas largimit të stimulit. Shembujt e raportuar përfshijnë kokëdhembjen nga mbajtja e helmetës ose syzeve të notit dhe tërheqja e flokëve.
KOKËDHEMBJA PRIMARE THERRËSE
Pacientët me kokëdhembje primare therëse e përshkruajnë kokëdhembjen si të shkurtër, jashtëzakonisht të mprehtë, që ndodhë pa paralajmërim dhe mund të ndihet kudo në kokë, duke përfshirë regjionin orbital. Kokëdhembjet përsëriten me frekuencë të parregullt, një ose shumë herë në ditë. Kokëdhembjet therëse shfaqen më shpesh tek pacientët subjekt të migrenës, kokëdhembjes cluster dhe hemikranisë së vazhdueshme. Për shkak të kohëzgjatjes së shkurtër së dhimbjes, natyrës sporadike të sulmeve dhe remisioneve spontane, trajtimi zakonisht nuk kërkohet dhe siguria në përgjithësi mjafton. Megjithatë, në pacientët me "status icepick", trajtimi i zgjedhur është indometacina e administruar në një regjim të ngjashëm ndaj asaj të përshkruar për HP. Frenuesit e ciklooksigjenazës-2 (COX-2),gabapentina dhe melatonina gjithashtu të dobishme.
KOKËDHEMBJA NUMULARE
Kokëdhembja numulare, e quajtur më parë kokëdhembja në formë monedhe, është një kokëdhembje fokale e ndjerë në një zone të vogël, të fiksuar, të mirëpërcaktuar, të rrumbullakosur ose eliptike e kokës, zakonisht 1-6 cm në diametër.Kokëdhembja zakonisht përshkruhet si presion ose therjedhe është shpeshe shoqëruar me hipostezi, dizestezi, parestezi, apo alodini.
Një pakicë pacientësh mund të zhvillojnë ndryshime trofike si rënia e flokëveose një copë depresioni të lëkurës. Kokëdhembje të ngjashme janë të lidhura me lezione strukturore si meningiomën, cistet arahnoidale dhe displazinë fibroze të kafkës. Prandaj është e rëndësishme realizimi i imazherisë për të përjashtuar faktorët strukturor. Injeksionet lokale të anestezisë në përgjithësi nuk janë të dobishëm. Studimet sugjerojnë se gabapentin (300-1800 mgçdo ditë), antidepresantët triciklikë dhe onabotulinum toksinaA mund të jenë të dobishëm. Ndërsa një studim tjetër sugjeron që arterektomia lokale mund të ndihmojë në një grup të caktuar pacientësh, por nuk është trajtimi rutinor i rekomanduar.
KOKËDHEMBJA HIPNIKE
Kokëdhembja hipnike është një çrregullim primar i kokëdhembjes ku sulmet shfaqen ekskluzivisht gjatë gjumit, shpesh në mes të orës 2 të mëngjesit dhe orës 4 të mëngjesit. Mosha mesatare e pacientëve gjatë shfaqjes së kokëdhembjes është 63 vjeç. Kokëdhembjezakonisht është e lehtë deri në mesatare, por 20% e pacientëve raportojnë dhimbje të forta.Kokëdhembja është e dyanshme në rreth dy të tretat e rasteve. Sulmi zakonishtzgjat nga 15–180 minuta, por janë përshkruar kohëzgjatje më të gjata.Kafeina para gjumit është shpesh e dobishme në parandalimin e kokëdhembjes hipnike. Litiumi, melatonina dhe indometacina gjithashtu mund të jenë të dobishmenë parandalimin e kokëdhembjes hipnike. Pacientët që reagojnë ndaj gabapentinës, pregabalinës,verapamilit, acetazolamidit, onabotulinum toksinës A dhe topiramatit janë raportuar gjithashtu.
KOKËDHEMBJA DITORE E RE PERSISTENTE
Kokëdhembja ditore e re persistente (NDPH) është një kokëdhembje e përditshme që nuk pushonnga fillimi ose shumë shpejtë pas fillimit (më së shumti brenda 24 orëve). Shumica dërrmuese e pacientëve mund të përcaktojnë datën e saktë kur filloi dhimbja e kokës. Infeksionet, sëmundjet e ngjashme me gripin, intervenimet kirurgjikedhe ngjarjet stresuese mund t'i paraprijnë NDPH. Se si këto mund të rezultojnë në NDPH ështëe paqartë dhe më shumë se gjysma e pacientëve nuk e njohin një shkaktar ose ngjarje precipituese. Klinikisht NDPH mund të ketë veçori të migrenës ose kokëdhembjes të tipit tension. Në përgjithësi, nëse nuk është gjetur shkaku dytësor,kokëdhembja rekomandohet të klasifikohet në bazë tëfenotipit mbizotërues, pavarësisht nëse është migrenë ose llojit kokëdhembjes të tipit të tensionit dhe të trajtohet me masa parandaluese.
Referencat:
- Bradley and Daroffs Neurology in clinical practice (Joseph Jankovic, John C. Mazziotta etc.), 8th edition, 2021.
Përgatiti: Ass. Dr. Esra Zhubi
Redaktoi: Ass. Dr. Blerim Myftiu
SËMUNDJA E ALZHEIMERIT
Sëmundja e Alzheimerit është një çrregullim i trurit që përkeqësohet me kalimin e kohës. Karakterizohet nga ndryshime në tru që çojnë në depozitime të proteinave të caktuara. Sëmundja e Alzheimerit bën që truri të tkurret në vëllim (atrofohet) dhe qelizat e trurit të vdesin përfundimisht. Sëmundja e Alzheimerit është shkaku më i zakonshëm i demencës, e cila përcillet me rënie graduale të kujtesës, të menduarit, të sjelljes dhe të aftësive sociale. Këto ndryshime ndikojnë në aftësinë e një personi për të funksionuar.
Rreth 6.5 milionë njerëz në Shtetet e Bashkuara të moshës 65-vjeç e lartë jetojnë me sëmundjen e Alzheimerit. Midis tyre, më shumë se 70% janë 75-vjeç e lartë. Nga rreth 55 milionë njerëz në mbarë botën me demencë, 60-70% vlerësohet ta kenë sëmundjen e Alzheimerit.
Shenjat e hershme të sëmundjes përfshijnë harresën e ngjarjeve ose bisedave të fundit. Me kalimin e kohës, ajo përparon në probleme serioze të kujtesës dhe humbje të aftësisë për t’i kryer detyrat e përditshme. Barnat mund ta përmirësojnë ose ngadalësojnë përparimin e simptomave.
Nuk ka trajtim që e shëron sëmundjen e Alzheimerit. Në fazat e avancuara, humbja e rëndë e funksionit të trurit mund të shkaktojë dehidrim, kequshqyerje ose infeksione. Këto komplikime mund të rezultojnë në vdekje.
Simptomat
Humbja e kujtesës është simptoma kryesore e sëmundjes së Alzheimerit. Shenjat e hershme përfshijnë vështirësinë në kujtimin e ngjarjeve ose të bisedave të fundit. Por kujtesa përkeqësohet dhe simptoma të tjera zhvillohen ndërsa sëmundja përparon.
Në fillim, vetë personi mund të jetë i vetëdijshëm se ka vështirësi në kujtimin e gjërave dhe në të menduarit qartë. Me përkeqësimin e simptomave, anëtarët e familjes ose miqtë ka më shumë mundësi t’i vënë re problemet.
Ndryshimet e trurit të lidhura me sëmundjen e Alzheimerit çojnë në probleme në rritje me:
Kujtesën – Shumë njerëz kanë probleme me kujtesën nganjëherë, por humbja e kujtesës e lidhur me sëmundjen e Alzheimerit vazhdon dhe përkeqësohet. Me kalimin e kohës, humbja e kujtesës ndikon në aftësinë për të funksionuar në punë ose në shtëpi. Njerëzit me sëmundjen e Alzheimerit mund të:
- Përsëritin deklaratat/shprehjet dhe pyetjet pa pushim.
- Harrojnë bisedat, takimet ose ngjarjet.
- Vendosin sendet gabim, shpesh duke i vendosur në vende që nuk kanë kuptim.
- Humbin në vende që dikur i njihnin mirë.
- Harrojnë përfundimisht emrat e anëtarëve të familjes dhe sendet e përditshme.
- Kenë vështirësi për të gjetur fjalët e duhura për objektet, për të shprehur mendimet ose për të marrë pjesë në biseda.
Të menduarit dhe arsyetimin – Sëmundjae Alzheimerit shkakton vështirësi në përqendrim dhe të menduar, veçanërisht për konceptet abstrakte si numrat. Është veçanërisht e vështirë të bëhet më shumë se një detyrë në të njëjtën kohë. Mund të jetë sfidues menaxhimi i financave, balancimi i llogarive dhe pagesa e faturave në kohë. Përfundimisht, një person me sëmundjen e Alzheimerit mund të mos jetë në gjendje t’i njohë dhe të përballet me numrat.
Gjykimin dhe vendimmarrjen – Sëmundjae Alzheimerit shkakton rënie të aftësisë për të marrë vendime dhe gjykime të arsyeshme në situatat e përditshme. Për shembull, një person mund të bëjë zgjedhje të dobëta në mjediset sociale ose të veshë rroba për llojin e gabuar të motit. Mund të bëhet më e vështirë për dikë që t'u përgjigjet problemeve të përditshme. Për shembull, personi mund të mos dijë si ta trajtojë djegien e ushqimit në stufë ose vendimet gjatë drejtimit të veturës.
Planifikimin dhe kryerjen e detyrave të njohura – Aktivitetet rutinë që kërkojnë plotësimin e hapave të njëpasnjëshme në drejtim të kryerjes së një pune të zakonshme. Kjo mund të përfshijë planifikimin dhe gatimin e një vakti ose luajtjen e një loje të preferuar. Përfundimisht, njerëzit me sëmundje të avancuar të Alzheimerit harrojnë se si t’i bëjnë detyrat themelore si veshja dhe larja.
Ndryshimet në personalitet dhe sjellje – Ndryshimete trurit që ndodhin në sëmundjen e Alzheimerit mund të ndikojnë në disponimin dhe sjelljet. Problemet mund të përfshijnë: depresionin, humbjen e interesit për aktivitetet, tërheqjen sociale, luhatjen e humorit, mosbesimin tek të tjerët, zemërimin apo agresionin, ndryshimet në zakonet e gjumit, humbjen e frenimeve të epsheve, iluzionet (të tilla sikur të besosh se diçka është vjedhur).
Aftësitë e ruajtura
Pavarësisht ndryshimeve të mëdha në kujtesë dhe aftësi, njerëzit me sëmundjen e Alzheimerit janë në gjendje të mbajnë disa aftësi edhe kur simptomat përkeqësohen. Aftësitë e ruajtura mund të përfshijnë leximin ose dëgjimin e librave, rrëfimin e historive, ndarjen e kujtimeve, këndimin, dëgjimin e muzikës, kërcimin, vizatimin ose kryerjen e veprave artizanale. Këto aftësi mund të ruhen më gjatë sepse ato kontrollohen nga pjesët e trurit të prekura më vonë gjatë rrjedhës së sëmundjes.
Kur të vizitoni një mjek?
Një sërë shkaqesh mund të rezultojnë në humbje të kujtesës ose simptoma të tjera të demencës. Disa nga këto shkaqe mund të trajtohen. Nëse jeni të shqetësuar për kujtesën tuaj ose aftësi të tjera të të menduarit, bisedoni me profesionistin tuaj të kujdesit shëndetësor. Nëse jeni të shqetësuar për aftësitë e të menduarit që vëzhgoni te një anëtar i familjes ose një mik, flisni për shqetësimet tuaja dhe pyesni për të shkuar së bashku për të biseduar me një profesionist të kujdesit shëndetësor.
Shkaktarët
Shkaqet e sakta të sëmundjes së Alzheimerit nuk janë kuptuar plotësisht. Në nivelin bazë, proteinat e trurit nuk funksionojnë si zakonisht. Kjo prish punën e qelizave të trurit, të quajtura neurone dhe inicion një sërë ngjarjesh patologjike. Neuronet dëmtohen dhe humbasin sinapsat (lidhjet) me njëri-tjetrin. Ato përfundimisht vdesin.
Shkencëtarët besojnë se sëmundja e Alzheimerit shkaktohet nga kombinimi i faktorëve gjenetikë, stilit të jetesës dhe mjedisit – që ndikojnë në tru me kalimin e kohës. Në më pak se 1% të rasteve, sëmundja e Alzheimerit shkaktohet nga ndryshime specifike gjenetike që e bëjnë të sigurt që një person ta zhvillojë sëmundjen. Në këto raste, sëmundja zakonisht fillon në moshën e mesme.
Zhvillimi i sëmundjes fillon vite përpara simptomave të para. Dëmi më shpesh fillon në zonën e trurit që e kontrollon kujtesën. Humbja e neuroneve përhapet në një model disi të parashikueshëm në zona të tjera të trurit. Në fazën e fundit të sëmundjes, truri tkurret ndjeshëm.
Studiuesit që përpiqen të kuptojnë shkakun e sëmundjes së Alzheimerit janë fokusuar në rolin e dy proteinave:
- Beta-amiloidi është fragment i një proteine më të madhe. Kur këto fragmente grumbullohen së bashku, ato duket se kanë një efekt toksik mbi neuronet dhe prishin komunikimin midis qelizave të trurit. Këto grumbullime formojnë depozita më të mëdha të quajtura pllaka amiloide, të cilat përfshijnë gjithashtu mbeturina të tjera qelizore.
- Proteinat tau luajnë një rol në mbështetjen e brendshme të qelizave të trurit dhe sistemin e transportit për të transportuar lëndë ushqyese dhe materiale të tjera thelbësore. Në sëmundjen e Alzheimerit, proteinat tau ndryshojnë formë dhe organizohen në struktura të quajtura ngatërrime neurofibrilare. Ngatërresat prishin sistemin e transportit dhe shkaktojnë dëme në qeliza.
Faktorët e rrezikut
Mosha
Rritja e moshës është faktori më i madh i rrezikut i njohur për sëmundjen e Alzheimerit. Sëmundja e Alzheimerit nuk është pjesë e plakjes tipike. Por me rritjen e moshës, gjasat për ta zhvilluar atë rriten. Një studim ka zbuluar se në çdo vit diagnostikohen 4 raste të reja për 1 mijë banorë të moshës 65-74 vjeç. Midis njerëzve të moshës 75-84 vjeç, kishte 32 raste të reja për 1 mijë banorë. Për ata 85 vjeç e lart, janë 76 raste të reja për 1 mijë banorë.
Historia familjare dhe gjenetika
Rreziku i zhvillimit të sëmundjes së Alzheimerit është disi më i lartë nëse një i afërm i shkallës së parë – prindi ose vëllai ose motra –e ka sëmundjen. Se si gjenet midis familjeve ndikojnë në rrezik është kryesisht e pashpjegueshme dhe faktorët gjenetikë ka të ngjarë të jenë komplekse. Faktori gjenetik i kuptuar më së miri është një formë e gjenit të apolipoproteinës E (APOE). Një formë e gjenit, APOE e4, e rrit rrezikun e sëmundjes së Alzheimerit. Rreth 25-30% e popullsisë bart alelin APOE e4. Por jo të gjithë me këtë formë të gjenit e zhvillojnë sëmundjen. Shkencëtarët kanë gjetur ndryshime të rralla në tre gjene që praktikisht e bëjnë të sigurt se një person që trashëgon njërin prej tyre do ta zhvillojë sëmundje e Alzheimerit. Por këto ndryshime përbëjnë më pak se 1% të njerëzve me sëmundjen e Alzheimerit.
Sindroma Down
Shumë njerëz me sindromën Down e zhvillojnë sëmundjen e Alzheimerit. Kjo ka të ngjarë të lidhet me të pasurit e tre kopjeve të kromozomit 21. Kromozomi 21 është gjeni i përfshirë në prodhimin e proteinës që çon në krijimin e beta-amiloidit. Fragmentet beta-amiloide mund të shndërrohen në pllaka trunore. Simptomat kanë prirje të shfaqen 10 deri në 20 vjet më herët tek njerëzit me sindromën Down sesa tek popullata e përgjithshme.
Gjinia
Në përgjithësi, ka më shumë gra me këtë sëmundje, sepse ato kanë tendencë të jetojnë më gjatë se burrat.
Dëmtimi i lehtë kognitiv
Dikush me dëmtim të lehtë kognitiv (MCI) ka rënie në kujtesë ose aftësi të tjera të të menduarit që është më e madhe se zakonisht për moshën e personit. Por rënia nuk e pengon personin të funksionojë në mjedise sociale ose të punës.
Megjithatë, njerëzit me MCI kanë rrezik të konsiderueshëm të zhvillimit të demencës. Kur MCI-jae prek kryesisht kujtesën, gjendja ka më shumë gjasa të përparojë në demencë të Alzheimerit. Një diagnozë e MCI-së u ofron njerëzve mundësinë për të vënë një fokus më të madh në ndryshimet e stilit të jetesës së shëndetshme dhe për të gjetur strategji për ta kompensuar humbjen e kujtesës. Ata gjithashtu mund të caktojnë takime të rregullta të kujdesit shëndetësor për t’i monitoruar simptomat.
Trauma e kokës
Disa studime të mëdha zbuluan se njerëzit e moshës 50 vjeç ose më të vjetër që kishin dëmtim traumatik të trurit (TBI) kishin rrezik të shtuar për zhvillimin e demencës dhe të sëmundjes së Alzheimerit. Rreziku është edhe më i lartë te njerëzit me TBI më të rënda dhe të shumëfishta. Disa studime zbuluan se rreziku mund të jetë më i madh brenda 6 muajve të parë deri në 2 vite pas lëndimit.
Ndotja e ajrit
Studimet në kafshë kanë zbuluar se grimcat e ndotjes së ajrit mund ta përshpejtojnë dëmtimin e sistemit nervor. Dhe studimet njerëzore kanë zbuluar se ekspozimi ndaj ndotjes së ajrit – veçanërisht nga shkarkimi i trafikut dhe djegia e drurit – lidhet me një rrezik më të madh të demencës.
Konsumimi i tepërt i alkoolit
Pirja e sasive të mëdha të alkoolit është njohur prej kohësh se shkakton ndryshime në tru. Disa studime dhe rishikime sistematike të literaturës zbuluan se çrregullimet e përdorimit të alkoolit ishin të lidhura me rrezikun e shtuar për demencë – në veçanti për demencë të hershme.
Cilësia e dobët e gjumit
Hulumtimet kanë treguar se cilësia e dobët e gjumit, si problemet për të fjetur ose qëndrimi më i gjatë në gjumë, janë të lidhura me rrezik të shtuar për sëmundjene Alzheimerit.
Mënyra e jetesës dhe shëndeti i zemrës
Hulumtimet kanë treguar se të njëjtit faktorë rreziku të lidhur me sëmundjet e zemrës gjithashtu mund ta rrisin rrezikun e demencës. Është e paqartë nëse këta faktorë e rrisin rrezikun e demencës duke i përkeqësuar ndryshimet e Alzheimerit në tru ose duke çuar në ndryshime vaskulare të trurit. Ato i përfshijnë faktorët e modifikueshëm, siç janë mungesa e aktivitetit fizik, obeziteti, pirja e duhanit ose ekspozimi ndaj tymit të dorës së dytë, tensioni i lartë i gjakut, kolesteroli i lartë dhe diabeti melit i tipit 2 i kontrolluar keq. Të gjithë këta faktorë mund të modifikohen. Prandaj, ndryshimi i shprehive të jetesës mund të ndryshojë në një farë mase rrezikun. Për shembull, stërvitja e rregullt dhe një dietë e shëndetshme me pak yndyrë, e pasur me fruta dhe perime lidhen me një rrezik më të ulët të sëmundjes së Alzheimerit.
Të mësuarit gjatë gjithë jetës dhe angazhimi social
Studimet kanë zbuluar se shoqërimi dhe përfshirja në aktivitete që stimulojnë mendjen gjatë gjithë jetës mund ta ulin rrezikun për sëmundjene Alzheimerit. Nivelii ulët i arsimit – mëpak se arsimi i mesëm – duketse është faktor rreziku për sëmundjen e Alzheimerit.
Komplikimet
Simptomat e Alzheimerit si humbja e kujtesës, humbja e aftësisë së gjuhës së të folurit, gjykimi i dëmtuar dhe ndryshime të tjera të trurit mund ta bëjnë më të vështirë menaxhimin e kushteve të tjera shëndetësore. Një person me sëmundjen e Alzheimerit mund të mos jetë në gjendje t’i tregojë dikujt për dhimbjen, të shpjegojë simptomat e një sëmundjeje tjetër, të ndjek një plan trajtimi apo t’i shpjegojë efektet anësore të barnave. Ndërsa sëmundja e Alzheimerit shkon drejt fazës së saj të fundit, ndryshimet e trurit fillojnë të ndikojnë në funksionet fizike. Ndryshimet mund të ndikojnë në aftësinë për të gëlltitur, në drejtpeshim dhe kontrollimin e lëvizjevetë zorrëve dhe fshikëzës. Këto efekte mund të çojnë në probleme të tjera shëndetësore si aspirimi i ushqimit ose lëngjeve në mushkëri, grip, pneumoni dhe infeksione të tjera, rrëzime, fraktura, plagë të shtratit, ushqyeshmëri të dobët ose dehidrim, kapsllëk ose barkqitje, probleme dentare si plagë në gojë ose prishje të dhëmbëve.
Parandalimi
Sëmundja e Alzheimerit nuk është një gjendje e parandalueshme. Megjithatë, një sërë faktorësh rreziku të stilit të jetesës mund të modifikohen. Provat sugjerojnë se marrja e hapave për të zvogëluar rrezikun e sëmundjeve kardiovaskulare mund të ulë gjithashtu rrezikun e zhvillimit të demencës. Për të ndjekur një mënyrë jetese të shëndetshme për zemrën që mund të zvogëlojë rrezikun e demencës, duhet të ushtrohet rregullisht, të konsumohet dieta me produkte të freskëta, vajra të shëndetshëm dhe ushqime me pak yndyrna të ngopura (dieta mesdhetare), të ndiqen udhëzimet e trajtimit për menaxhimin e tensionit të lartë të gjakut, diabetit dhe kolesterolit të lartë. Nëse pini duhan, kërkoni ndihmë nga profesionisti juaj shëndetësor për ta lënë duhanin.
Një studim i madh dhe afatgjatë i bërë në Finlandë zbuloi se bërja e ndryshimeve në stilin e jetës ndihmoi në uljen e rënies kognitive tek njerëzit që ishin në rrezik të demencës. Atyre në studim iu dhanë seanca individuale dhe grupore që përqendroheshin në dietë, stërvitje dhe aktivitete sociale.
Në një studim tjetër të bërë në Australi, njerëzve në rrezik të demencës iu dhanë seanca stërvitore mbi dietën, stërvitjen dhe ndryshimet e tjera të stilit të jetesës. Ata patën rezultate më të mira në testet njohëse pas një, dy dhe tre vjetësh në krahasim me njerëzit që nuk morën trajnime.
Studime të tjera kanë treguar se qëndrimi i angazhuar mendërisht dhe shoqërisht lidhet me ruajtjen e aftësive të të menduarit më vonë në jetë dhe një rrezik më të ulët të sëmundjes së Alzheimerit. Kjo përfshin shkuarjen në ngjarje shoqërore, lexim, vallëzim, lojëra në tavolinë, krijimin e artit, luajtjen e një instrumenti dhe aktivitete të tjera.
REFERENCAT:
1. Mayo Clinic – Alzheimer’s disease https://www.mayoclinic.org/diseases-conditions
2. NHS – Alzheimer’s disease https://www.nhs.uk/conditions/
Përgatiti: Dr. Leart Rruka
Redaktoi: Ass. Dr. Blerim Myftiu
MIGRENA
Migrena është një lloj i kokëdhimbjeve parësore, e karakterizuar nga episode të përsëritura të kokëdhimbjes, më shpesh të njëanshme dhe në disa raste të shoqëruara me simptoma vizuale ose shqisore - të njohura kolektivisht si aura - që shfaqen më shpesh përpara kokëdhimbjes, por që mund të ndodhin gjatë ose më pas. Migrena shpesh shoqërohet me mundim, të vjella dhe ndjeshmëri ekstreme ndaj dritës dhe zërit. Kokëdhimbjet e migrenës mund të zgjasin me orë të tëra deri në ditë dhe dhimbja mund të jetë aq e rëndë sa të ndërhyjë në aktivitetet tuaja të përditshme. Migrena është më e shpeshtë tek gratë dhe ka një komponentë të fortë gjenetike.
ETIOLOGJIA
Kokëdhimbja e migrenës me ose pa aurë në përgjithësi tregon një model shumëfaktorial të trashëgimisë, por natyra specifike e ndikimit gjenetik ende nuk është kuptuar plotësisht. Përafërsisht 70% e pacientëve me migrenë kanë një të afërm të shkallës së parë me një histori të migrenës. Rreziku i migrenës është i katërfishuar te të afërmit e njerëzve që kanë migrenë me aurë.
Faktorët precipitues
Janë identifikuar disa faktorë precipitues të kokëdhimbjeve të migrenës:
- Ndryshimet hormonale, të tilla si ato që shoqërojnë menstruacionet, shtatzëninë dhe ovulimin
- Stresi
- Gjumi i tepërt ose i pamjaftueshëm
- Medikamentet (p.sh. vazodilatorë, kontraceptivë oral)
- Pirja e duhanit
- Ekspozimi ndaj dritës së ndritshme ose fluoreshente
- Erëra të forta (p.sh. parfume, kolonja, distilime nafte)
- Trauma e kokës
- Ndryshimet e motit
- Sëmundja e lëvizjes (Motion sickness)
- Stimulimi i të ftohtit (p.sh. kokëdhimbje nga akullorja)
- Mungesa e aktivitetit fizik
- Agjërimi ose anashkalimi i vakteve
- Vera e kuqe
Disa ushqime dhe aditivë ushqimorë konsiderohen si nxitës të mundshëm të migrenës, duke përfshirë si vijon:
- Kafeina
- Ëmbëlsues artificialë (p.sh., aspartame, saharina)
- Glutamat mononatriumi (MSG)
- Agrumet
- Ushqimet që përmbajnë tiraminë (p.sh. djathi i vjetër)
- Mishrat me nitrite
PATOGJENEZA
Mekanizmi i shfaqjes së migrenës mbetet i pakuptuar plotësisht. Megjithatë, teknologjitë e reja kanë lejuar formulimin e koncepteve aktuale që mund të shpjegojnë pjesë të sindromës së migrenës.
Teoria vaskulare
Në vitet 1940 dhe 1950, teoria vaskulare u propozua për të shpjeguar patofiziologjinë e kokëdhimbjes nga migrena. Kjo teori propozon se ishemia e induktuar nga vazokonstriksioni intrakranial është përgjegjëse për aurën e migrenës dhe se vazodilatimi i mëpasshëm dhe aktivizimi i fijeve nervore nociceptive perivaskulare rezulton në kokëdhimbje. Kjo teori u bazua në tri observimet e mëposhtme:
- Enë ekstrakraniale të gjakut zgjerohen dhe pulsojnë gjatë një ataku migrenoz.
- Stimulimi i enëve intrakraniale të gjakut tek një person i zgjuar shkakton kokëdhimbje.
- Vazokonstriktorët përmirësojnë kokëdhimbjen, ndërsa vazodilatatorët provokojnë një atak migrenoz.
Megjithatë, kjo teori nuk shpjegon fazën prodromale dhe efikasitetin e disa barnave të përdorura për trajtimin e migrenës, që nuk kanë efekt në enët e gjakut dhe faktin që shumica e pacientëve nuk kanë një aurë. Për më tepër, me përsosjen e teknologjive më të reja të imazherisë, studiuesit zbuluan se modelet e rrjedhës së gjakut intrakranial nuk ishin në përputhje me teorinë vaskulare. Asnjë ndryshim i qëndrueshëm i rrjedhës nuk është identifikuar në pacientët që vuajnë nga kokëdhimbja e migrenës pa aura. Rrjedha regjionale e gjakut cerebral (rCBF) mbetet normale në shumicën e pacientëve. Megjithatë, është raportuar një rënie dypalëshe e rCBF, duke filluar në korteksin okcipital dhe duke u përhapur në korteksin përpara. Si rezultat i këtyre gjetjeve anormale, teoria vaskulare u zëvendësua nga teoria neurovaskulare.
Teoria neurovaskulare
Teoria neurovaskulare sugjeron se një seri ngjarjesh komplekse nervore dhe vaskulare inicojnë migrenën. Sipas kësaj teorie, migrena është kryesisht një proces neurogjenik me ndryshime dytësore në perfuzionin cerebral. Në fillim një migrenë nuk ka ndonjë kokëdhimbje, por ka një gjendje të hipereksitueshmërisë neuronale në korteksin cerebral, veçanërisht në korteksin okcipital. Ky zbulim është demonstruar në studimet e stimulimit magnetik transkranial dhe me imazhe të rezonancës magnetike funksionale (fMRI).
Depresioni i përhapjes kortikale (CDS)
CSD është një valë e përcaktuar e ngacmimit neuronal në lëndën gri kortikale që përhapet nga vendi i origjinës me shpejtësinë 2-6 mm/min. Ky depolarizim qelizor shkakton fenomenin kortikal primar ose fazën e aurës; nga ana tjetër, aktivizon fibrat trigeminale, duke shkaktuar fazën e kokëdhimbjes. Baza neurokimike e CSD është çlirimi i kaliumit ose glutamatit të aminoacidit ngacmues nga indi nervor. Ky lëshim depolarizon indin afër, i cili, nga ana tjetër, çliron më shumë neurotransmetues, duke përhapur depresionin në përhapje.
- Oligemia
Skanimi i tomografisë me emetim të pozitronit (PET) tregon se rrjedha e gjakut zvogëlohet mesatarisht gjatë një aure, por oligemia e përhapur nuk korrespondon me territoret vaskulare. Vetë oligemia është e pamjaftueshme për të dëmtuar funksionin. Në vend të kësaj, rrjedha zvogëlohet sepse depresioni i përhapur redukton metabolizmin. Megjithëse CSD është shqetësimi që supozohet se rezulton në manifestimin klinik të aurës së migrenës, kjo oligemi e përhapur mund të jetë klinikisht e heshtur (dmth. migrenë pa aurë). Ndoshta kërkohet një prag i caktuar për të prodhuar simptoma te pacientët që kanë aurë, por jo te ata pa aurë.
- Sistemi trigemino-vaskular
Aktivizimi i sistemit trigeminovaskular nga CSD stimulon neuronet nociceptive në enët e gjakut dural për të lëshuar proteina plazmatike dhe substanca që gjenerojnë dhimbje si peptidi i lidhur me gjenin e kalcitoninës, substanca P, peptidi vazoaktiv i zorrëve dhe neurokinina A. Gjendja rezultuese e inflamacionit shoqërohet me zgjerim të mëtejshëm të enëve, duke shkaktuar dhimbje.
Hiperperfuzioni fillestar kortikal në CSD ndërmjetësohet pjesërisht nga çlirimi i neurotransmetuesve trigeminal dhe parasimpatik nga fibrat nervore perivaskulare, ndërsa rritja e vonuar e rrjedhës së gjakut meningeal ndërmjetësohet nga një lidhje trigeminale-parasimpatike e trungut të trurit.
- Metalloproteinazat
Përveç kësaj, përmes një sërë mekanizmash molekularë, CSD rregullon lart gjenet, të tilla si ato që kodojnë për ciklo-oksigjenazën 2 (COX-2), faktorin e nekrozës së tumorit alfa (TNF-alfa), interleukin-1beta, galaninën dhe metaloproteinazat. Aktivizimi i metaloproteinazave çon në rrjedhje të barrierës gjaku-tru, duke lejuar që kaliumi, oksidi nitrik, adenozina dhe produkte të tjera të çliruara nga CSD të arrijnë dhe të sensibilizojnë mbaresat aferente trigeminale perivaskulare durale. Rritja e aktivitetit neto të matricës metalloproteinazë-2 (MMP-2) është demonstruar te pacientët me migrenë. Pacientët që kanë migrenë pa aurë duket se kanë një raport të rritur të metaloproteinazës së matricës-9 (MMP-9) ndaj frenuesve të indeve të metaloproteinazës-1 (TIMP-1), në kontrast me një raport më të ulët MMP-9/TIMP-1 te pacientët. të cilët kanë migrenë me aurë. Nivelet e matura vetëm të MMP-9 janë të njëjta për pacientët me migrenë me ose pa aurë.
- Hipoksia
Në një studim eksperimental, hipoksia akute u shkaktua nga një episod i vetëm i CSD. Kjo u shoqërua me dështim dramatik të homeostazës së joneve të trurit dhe dëmtim të zgjatur të bashkimit neurovaskular dhe neurometabolik.
Substancat vazoaktive dhe neurotransmetuesit
Aktiviteti nervor perivaskular gjithashtu rezulton në lirimin e substancave të tilla si substanca P, neurokinina A, peptidi i lidhur me gjenet e kalcitoninës dhe oksidi nitrik, të cilat ndërveprojnë me murin e enëve të gjakut për të prodhuar zgjerim, ekstravazim të proteinave dhe inflamacion. Kjo stimulon kompleksin trigemino-cervikal. Informacioni më pas transmetohet në talamus dhe korteks për përceptimin e dhimbjes. Përfshirja e qendrave të tjera mund të shpjegojë simptomat autonome të lidhura dhe aspektet afektive të kësaj dhimbjeje. Ekstravazimi i plazmës i induktuar neurogjenikisht mund të luajë një rol në shprehjen e dhimbjes në migrenë, por mund të mos jetë i mjaftueshëm në vetvete për të shkaktuar dhimbje. Megjithëse disa barna që janë efektive për migrenën frenojnë ekstravazimin neurogjenik të plazmës, antagonistët e substancës P dhe antagonisti i endotelinës pengojnë ekstravazimin neurogjenik të plazmës, por janë joefektive si ilaçet antimigrenë. Gjithashtu, procesi i dhimbjes kërkon jo vetëm aktivizimin e nociceptorëve të strukturave intrakraniale që prodhojnë dhimbje, por edhe reduktimin e funksionimit normal të rrugëve endogjene të kontrollit të dhimbjes që parandalojnë dhimbjen.
Qendra e migrenës
Është propozuar një "qendër e migrenës" në trungun e trurit, bazuar në rezultatet e PET-skanimit që tregojnë rCBF vazhdimisht të ngritur në trungun e trurit (d.m.th., gri periaqueduktale, formacioni retikular i trurit të mesëm, locus ceruleus) edhe pastrajtimit të kokëdhimbjes nga sumatriptanit. Rritja e rCBF nuk u vu re para ose pas episodave të migrenës, duke sugjeruar që ky aktivizim nuk ishte për shkak të perceptimit të dhimbjes ose rritjes së aktivitetit të sistemit endogjen antinociceptiv. Fakti që sumatriptani ndryshoi rritjen konkomitante të rCBF në korteksin cerebral, por jo në qendrat e trungut të trurit, sugjeron disfunksionim në rregullimin e përfshirë në antinociceptimin dhe kontrollin vaskular të këtyre qendrave. Dihet se përpunimi talamik i dhimbjes është i kufizuar nga fibrat serotonergjike ngjitëse nga bërthama raphedorsale dhe nga bërthamat aminergjike në tegmentumin pontine dhe locus ceruleus. Kjo e fundit mund të ndryshojë rrjedhën e trurit dhe përshkueshmërinë e barrierës gjaku-tru. Për shkak të periodicitetit të caktuar të migrenës, është propozuar lidhja me bërthamën suprakiazmatike të hipotalamusit që rregullon ritmin cirkadian. Zbulimi i shkaktarit qendror të migrenës do të ndihmonte në identifikimin e agjentëve më të mirë profilaktikë.
Aktivizimi i trurit
Skanimi PET në pacientët që kanë një kokëdhimbje akute migrene demonstron aktivizimin e ponsit kontralateral, edhe pasi medikamentet e ndërpresin dhimbjen. Pasi CSD ndodh në sipërfaqen e trurit, jonet H+ dhe K+ shpërndahen në piamater dhe aktivizojnë nociceptorët meningeal të fibrave C, duke lëshuar një kombinim proinflamatorëve (p.sh., peptidet e lidhura me gjenet e kalcitoninës) dhe duke shkaktuar ekstravazim plazmatik. Prandaj, është i pranishëm një inflamacion neurogjen i kompleksit trigeminovaskular. Pasi sistemi trigeminal është aktivizuar, ai stimulon enët kraniale të zgjerohen. Rruga e fundit e përbashkët drejt kokëdhimbjes pulsuese është zgjerimi i enëve të gjakut.
Alodinia e lëkurës
Burstein et al. përshkruan fenomenin e alodinisë së lëkurës, në të cilën rrugët dytësore të dhimbjes të sistemit trigemino-talamik bëhen të ndjeshme gjatë një episodi migrenoz. Ky hulumtim tregon se, së bashku me ngjarjet neurovaskulare të përshkruara më parë, sensibilizimi i rrugëve qendrore në tru ndërmjetëson dhimbjen e migrenës.
Rruga e dopaminës
Disa autorë kanë propozuar një bazë dopaminergjike për migrenën. Disa nga simptomat e lidhura me kokëdhumbjen nga migrena, të tilla si mundim, të vjella, nervozizëm, hipotension dhe hiperaktivitet, mund t'i atribuohen stimulimit relativ dopaminergjik. Hipersensitiviteti i receptorit të dopaminës është treguar eksperimentalisht me agonistët e dopaminës (p.sh., apomorfina). Antagonistët e dopaminës (p.sh. proklorperazina) lehtësojnë plotësisht pothuajse 75% të episodave akute të migrenës.
Mungesa e magnezit
Një teori tjetër propozon që mungesa e magnezit në tru shkakton një zinxhir ngjarjesh, duke filluar me grumbullimin e trombociteve dhe çlirimin e glutamatit dhe në fund rezulton në çlirimin e 5-hidroksitriptaminës, e cila është një vazokonstriktor.
Mosfunksionimi i endotelit
Mosfunksionimi i qelizave të muskujve të lëmuar të enëve të gjakut mund të përfshijë dëmtim të guanozinësmonofosfat ciklik dhe përgjigje hemodinamike ndaj oksidit nitrik. Oksidi nitrik i çliruar nga mikroglia është një ndërmjetës potencialisht citotoksik proinflamator, duke inicuar dhe mbajtur inflamacionin e trurit nëpërmjet aktivizimit të sistemit të neuroneve trigeminale. Nivelet e oksidit nitrik vazhdojnë të rriten edhe në periudhën pa kokëdhimbje tek ata që kanë migrenë. Në gratë para menopauzës me migrenë, veçanërisht në ato me aurë migrene, është i dukshëm aktivizimi i rritur i endotelit i cili është një komponent i mosfunksionimit endotelial.
Serotonina dhe migrena
Receptori i serotoninës (5-hidroksitriptamina [5-HT]) besohet të jetë receptori më i rëndësishëm në rrugën e kokëdhimbjes. Studimet imunohistokimike kanë zbuluar receptorët 5-hidroksitriptaminë-1D (5-HT1D) në neuronet shqisore trigeminale, duke përfshirë projeksionet periferike në dura dhe brenda bërthamës trigeminale caudalis (TNC) dhe traktit solitar, ndërsa receptorët 5-HT1B janë të pranishëm në qelizat e muskujve të lëmuar dhe në enët meningeale. Megjithatë, të dyja mund të gjenden edhe në enët koronare. Të gjithë triptanët aktualisht të disponueshëm janë agonistë të plotë 5-HT1B/D. Këta agjentë mund të ulin kokëdhimbjen duke ndërprerë lirimin e neuropeptideve në periferi dhe duke bllokuar neurotransmetimin duke vepruar në neuronet e rendit të dytë në kompleksin trigeminocervikal.
PARAQITJA KLINIKE (SIMPTOMAT DHE SHENJAT)
Simptomat tipike të migrenës përfshijnë si më poshtë:
- Kokëdhimbje pulsuese, me dhimbje të moderuar deri në atë të fortë që intensifikohet me lëvizjen ose aktivitetin fizik
- Dhimbje e njëanshme dhe e lokalizuar në zonën fronto-temporale dhe okulare, por dhimbja mund të ndihet kudo rreth kokës ose qafës
- Dhimbja krijohet gjatë një periudhe prej 1-2 orësh, duke përparuar dhe duke u përhapur
- Dhimbja e kokës zgjat 4-72 orë
- Nauze (80%) dhe të vjella (50%), duke përfshirë anoreksinë dhe intolerancën ushqimore, dhe marramendjen
- Ndjeshmëria ndaj dritës dhe zërit
Karakteristikat e aurës së migrenës janë si më poshtë:
- Mund të paraprijë ose të shoqërojë fazën e kokëdhimbjes ose mund të ndodhë në izolim
- Zakonisht zhvillohet mbi 5-20 minuta dhe zgjat më pak se 60 minuta
- Më së shpeshti vizuale, por mund të jetë shqisore, motorike ose ndonjë kombinim i tyre
- Simptomat vizuale mund të jenë pozitive ose negative
- Dukuria vizuale pozitive më e zakonshme është skotoma shkëlqyese, një hark ose brez i shikimit që mungon me një kufi zigzag vezullues.
Gjetjet fizike gjatë një kokëdhimbje migrene mund të përfshijnë si vijon:
- Ndjeshmëri e muskujve kranial/qafës së mitrës
- Sindroma Horner (p.sh., mioza relative me 1-2 mm ptozë në të njëjtën anë me kokëdhimbjen)
- Injeksion konjuktival
- Takikardi ose bradikardi
- Hipertension ose hipotension
- Deficitet neurologjike hemisensore ose hemiparetike (dmth. migrenë e komplikuar)
- Pupila e tipit Adie (d.m.th., reaktivitet i dobët ndaj dritës, me shkëputje pothuajse nga drita)
KLASIFIKIMI
Klasifikimi i migrenës është si më poshtë:
- Migrenë pa aurë (më parë, migrenë e zakonshme)
- Migrenë e mundshme pa aurë
- Migrena me aurë (më parë, migrena klasike)
- Migrenë e mundshme me aurë
- Migrenë kronike
- Migrena kronike e lidhur me përdorimin e tepruar të analgjezikëve
- Sindromat periodike të fëmijërisë që mund të mos jenë pararendëse ose të lidhura me migrenën
- Komplikimet e migrenës
- Çrregullimi migrenoz që nuk plotëson kriteret e mësipërme
Variantet e migrenës përfshijnë si më poshtë:
- Sindromat periodike të fëmijërisë
- Shoqëruesit migrenoz të jetës së vonë
- Migrenë me aurë të trungut trunoe
- Migrenë hemiplegjike
- Statusi i migrenës
- Migrena e retinës
Disa variante të migrenës mund të sugjerohen nga gjetjet fokale neurologjike, që fillojnë me kokëdhimbje dhe vazhdojnë përkohësisht pasi dhimbja të largohet:
- Migrena hemiplegjike - Paralizë ose dobësi e njëanshme
- Migrena me aurë të trungut trunor - dizartri, vertigo, ataksi
Migrena është një diagnozë klinike. Hulumtimet diagnostike kryhen për arsyet e mëposhtme:
- Përjashtimi i shkaqeve strukturore, metabolike dhe shkaqe të tjera të dhimbjes së kokës që mund të imitojnë ose shfaqen bashkë me migrenën
- Përjashtimi i sëmundjeve shoqëruese që mund të komplikojnë kokëdhimbjen dhe trajtimin e saj
- Vendosja e një bazë për trajtimin dhe përjashtimi i kundërindikacioneve për administrimin e barit
- Matja nivelet të barit për të përcaktuar përshtatjen, absorbimin ose mbidozën e ilaçeve
Realizimi i analizave laboratorike dhe hulumtimeve imazherike përcaktohet nga prezantimi individual. Zhvillimi i një matjeje objektive, sasiore biologjike të ashpërsisë së dhimbjes së kokës mund të ndihmojë në përmirësimin e diagnozës së migrenës dhe të mundësojë vlerësime më të sakta të efikasitetit të trajtimit.
FAKTORËT E RREZIKUT
Faktorët e rrezikut dhe predispozues për migrenën janë:
- Rritja e niveleve të proteinës C-reaktive
- Rritja e niveleve të interleukinave
- Rritja e niveleve të TNF-alfa dhe molekulave të adezionit
- Stresi oksidativ dhe tromboza
- Rritja e peshës trupore
- Presioni i lartë i gjakut
- Hiperkolesterolemia
- Ndjeshmëria e dëmtuar ndaj insulinës
- Nivele të larta të homocisteinës
- Insulti iskemik trunor
- Sëmundje koronare të zemrës
DIAGNOZA
Diagnoza e migrenës bazohet në historinë e pacientit. Bazuar në kriteret diagnostike të Shoqatës Ndërkombëtare të Kokëdhimbjes, pacientët duhet të kenë pasur të paktën pesë episode të kokëdhimbjes që kanë zgjatur 4-72 orë (të patrajtuara ose të trajtuara pa sukses) dhe se dhimbja e kokës duhet të ketë të paktën dy nga karakteristikat e mëposhtme:
- Lokalizimi unilateral
- Karakteri pulsues
- Intensiteti i moderuar ose ifortë i dhimbjes
- Përkeqësimi nga ose shkaktimi i shmangies së aktivitetit fizik rutinë (p.sh., ecja ose ngjitja e shkallëve)
Përveç kësaj, gjatë kokëdhimbjes pacienti duhet të ketë pasur të paktën një nga këto:
- Nauze dhe/ose të vjella
- Fotofobi dhe fonofobi
Indikacionet për neuroimazheri
Neuroimazheria nuk është e nevojshme në pacientët me një histori të kokëdhimbjeve të përsëritura të migrenës dhe një ekzaminim normal neurologjik. Neuroimazheria indikohet për cilindo nga si vijon:
- Dhimbja e parë ose më e rëndë e kokës
- Ndryshimi në modelin e migrenës së mëparshme
- Ekzaminimi neurologjik jonormal
- Fillimi i migrenës pas moshës 50 vjeç
- Fillimi i ri i kokëdhimbjes në një pacient me imunitet të kompromentuar (p.sh. një me kancer ose infeksion HIV)
- Kokëdhimbje me ethe
- Migrenë dhe epilepsi
- Kokëdhimbje e re e përditshme, e vazhdueshme
- Përshkallëzimi i shpeshtësisë/intensitetit të kokëdhimbjes në mungesë të përdorimit të tepërt të barnave
- Kokëdhimbje të lokalizuara pas (veçanërisht tek fëmijët, por edhe tek të rriturit)
Tomografia e kompjuterizuar (CT) e kokës indikohet për të përjashtuar masën ose hemorragjinë intrakraniale në raste të caktuara ose atipike. Një tomorgafi e kompjuterizuar negativ mund të mos detektoj disa hemorragji të vogla subarahnoidale, tumore dhe lezione iskemikE, veçanërisht ato në fosën e pasme. Një CT pa kontrast intravenoz gjithashtu mund të mos detektoj aneurizmat. MRI dhe MRA janë më të ndjeshme për zbulimin e aneurizmave ose keqformimeve arteriovenoze.
Indikacionet për punksionin lumbal
Indikacionet për punksionlumbal përfshijnë si më poshtë:
- Dhimbja e parë ose më e keqe e kokës në jetën e një pacienti
- Kokëdhimbje e rëndë, me fillim të shpejtë, të përsëritur
- Kokëdhimbjeme karakter progresiv
- Kokëdhimbje joresponsive në medikamente, kronike dhe e pazgjidhshme
DIAGNOZA DIFERENCIALE
Kur kokëdhimbja është episodike dhe e përsëritur dhe ndjek një model të caktuar, pacienti ka të ngjarë të ketë kokëdhimbje parësore (dmth. kokëdhimbje pa etiologji organike ose strukturore). Diferencimi i migrenës nga kokëdhimbjet e tjera parësore (p.sh., kokëdhimbje e tensionit të tkurrjes së muskujve, kokëdhimbje cluster) është e rëndësishme, pasi trajtimi optimal mund të ndryshojë. Migrena gjithashtu mund të simulojë ose të simulohet nga çrregullime dytësore të kokëdhimbjes ose të bashkëjetojë me një çrregullim dytësor të kokëdhumbjes.
Karakteristikat e mëposhtme sugjeron kokëdhimbje dytësore dhe kërkohet hulumtim i mëtejshëm:
- Kokëdhimbja e parë ose më e keqe në jetën e pacientit, veçanërisht nëse fillon me shpejtësi
- Një ndryshim në frekuencën, ashpërsinë ose karakteristikat klinike të kokëdhimbjes
- Kokëdhimbje e re progresive që vazhdon për ditë të tëra
- Precipitimi i kokëdhimbjes me manovrat e Valsalva (p.sh., kollitje, teshtitje, ulje)
- Prania e shenjave ose simptomave neurologjike tjera (p.sh. diplopia, humbja e ndjeshmërisë, dobësia, ataksia)
- Fillimi i kokëdhimbjes pas moshës 55 vjeç
- Kokëdhimbje që zhvillohet pas lëndimit të kokës ose traumës së madhe
- Kokëdhimbje pulsuese të vazhdueshme dhe të njëanshme
- Kokëdhimbje e shoqëruar me shtangim të qafës ose temperaturë
- Histori atipike ose karakter i pazakontë që nuk i plotëson kriteret për migrenë
- Përgjigje joadekuate ndaj terapisë optimale
Çrregullimet e tjera që duhet të merren parasysh para diagnostikimit të pacientëve me migrenë janë:
- Aneurizmat cerebrale
- Tromboza e sinusve venoz
- Tumoret e trurit
- Hemikrania paroksizmale kronike
- KokëdhimbjaCluster
- Kokëdhimbja nga sforcimi
- Disekacionispotan i arteries karotide interne
- Encefaliti nga Herpes Simplex
- Hemorragjia intrakraniale
- Kokëdhimbja nga tensioni i tkurrjes së muskujve
- Artriti temporal me qeliza të mëdha
- Sindroma Tolosa-Hunt
- Meningjiti viral
TRAJTIMI DHE PROGNOZA
Preparatet farmaceutike për trajtimin e migrenës mund të klasifikohen si abortive (dmth., për lehtësimin e fazës akute) ose profilaktike (dmth., parandaluese).
Medikamentet akute/abortive tentojnë të ndalojnë përparimin e kokëdhimbjes. Janë më efektive kur merren brenda 15 minutave nga fillimi i kokëdhimbjes dhe kur kokëdhimbja është e lehtë. Ato janë:
- Agonistë të receptorëve selektiv të serotoninës (5-hidroksitriptaminë-1, ose 5-HT1)
- Agonistët eserotoninës 5-HT1F (ditanët)
- Antagonistët e receptorit të peptidit të lidhur me gjenet e kalcitoninës (CGRP) (d.m.th., rimegepant, ubrogepant)
- Alkaloide të ergotave (p.sh., ergotaminë, dihidroergotaminë [DHE])
- Analgjezikët
- Barnat anti-inflamatore josteroidale (NSAIDs)
- Produktet e kombinuara
- Antiemetikë
Medikamente parandaluese/profilaktike mund të konsiderohen për terapinë profilaktike të migrenës kur:
- Frekuenca e episodave të migrenës është më e madhe se dy herë në muaj
- Kohëzgjatja e episodave individuale është më e gjatë se 24 orë
- Dhimbjet e kokës shkaktojnë ndërprerje të mëdha në stilin e jetës së pacientit, me paaftësi të konsiderueshme që zgjatë tri ose më shumë ditë
- Terapia aktute/abortive nuk është efektive
- Barnat simptomatike janë të kundërindikuara ose joefektive
- Përdorimi i barnave akute/abortive bëhet më shumë se dy herë në javë
- Variantet e migrenës si migrena hemiplegjike ose episodet e rralla të kokëdhimbjes që shkaktojnë rrezik të dëmtimit të përhershëm neurologjik
Medikamentet profilaktike përfshijnë si më poshtë:
- Medikamente antiepileptike
- Betabllokorë
- Antidepresantët triciklik
- Bllokuesit e kanalit të kalciumit
- Frenuesit selektivë të rimarrjes së serotoninës (SSRIs)
- Barnat anti inflamatore josteroidale (NSAIDs)
- Antagonistët e serotoninës
- Toksina botulinike
- Antagonistët e receptorit të peptidit të lidhur me gjenet e kalcitoninës (CGRP)
Trajtimi i migrenës mund të përfshijë gjithashtu:
- Reduktimin e nxitësve të migrenës (p.sh. mungesa e gjumit, lodhja, stresi, ushqime të caktuara)
- Terapinë jofarmakologjike (p.sh., biofeedback, terapi kognitive-biheviorale)
- Suplementet e ndryshme (p.sh.riboflavin, magnez, koenzima Q10)
Kokëdhimbja e transformuar nga migrena/përdorimi i tepërt i ilaçeve
Në disa pacientë, migrena përparon në migrenë kronike. Mbipërdorimi akut i barnave simptomatike konsiderohet si një nga faktorët më të rëndësishëm të rrezikut për përparimin e migrenës. Dhimbja e kokës nga përdorimi i tepërt i ilaçeve mund të ndodhë me çdo analgjezik, duke përfshirë acetaminofenin ose ilaçet anti-inflamatore josteroidale (NSAIDs), të tilla si ibuprofeni, naprokseni dhe aspirina. Përveç kësaj, janë identifikuar lidhjet e mëposhtme të mjekimit me përparimin në migrenë kronike:
- Opiatet - Doza kritike e ekspozimit është rreth 8 ditë në muaj; efekti është më i theksuar tek meshkujt.
- Barbituratet - Doza kritike e ekspozimit është rreth 5 ditë në muaj; efekti është më i theksuar tek femrat.
- Triptanet - Përparimi i migrenës shihet vetëm te pacientët me frekuencë të lartë të migrenës në fillim (10-14 ditë/muaj).
REFERENCAT:
Mayo Clinic – Migraine https://www.mayoclinic.org/diseases-conditions
NHS – Migraine https://www.nhs.uk/conditions/
Medscape – Migraine https://emedicine.medscape.com/
Përgatiti: Ass. Dr. EsraZhubi
Redaktoi: Ass. Dr. Blerim Myftiu
SËMUNDJA IDIOPATIKE E PARKINSONIT
Sëmundja e Parkinsonit është një çrregullim neurodegjenerativ progresiv që e prek sistemin ekstrapiramidal nervor dhe pjesët e trupit të kontrolluara nga ai. Simptomat fillojnë ngadalë. Simptoma e parë mund të jetë tremori (dridhja) mezi e dukshme në vetëm njërën dorë. Çrregullimi ekstrapiramidal gjithashtu mund të shkaktojë ngurtësi muskujsh (rigjiditet) dhe ngadalësim të lëvizjeve (bradikinezi).
Në fazat e hershme të sëmundjes së Parkinsonit, shprehjet e fytyrës suaj mund të jenë më pak të dukshme. Krahët mund të mos ju lëkunden kur ecni. Të folurit tuaj mund të bëhet i paqartë. Simptomat e sëmundjes së Parkinsonit përkeqësohen ndërsa gjendja juaj shëndetësore përkeqësohet me kalimin e kohës.
Megjithëse sëmundja e Parkinsonit nuk mund të shërohet, medikamentet mund t’i përmirësojnë ndjeshëm simptomat tuaja. Herë pas here, mjeku juaj mund të sugjerojë kirurgji për të vepruar në pjesë të caktuara të trurit tuaj dhe për t’i përmirësuar simptomat tuaja.
PARAQITJA KLINIKE
Simptomat e sëmundjes së Parkinsonit mund të jenë të ndryshueshme në persona të ndryshëm. Simptomat e hershme mund të jenë të lehta dhe të kalojnë pa u vënë re. Simptomat shpesh fillojnë në njërën anë të trupit dhe zakonisht mbeten më keq në atë anë, edhe pasi simptomat fillojnë të prekin gjymtyrët në të dy anët.
Simptomat e Parkinsonit mund të jenë të mëposhtmet:
- Tremori – dridhja. Dridhja ritmike, e quajtur tremor, zakonisht fillon në një gjymtyrë, shpesh në dorë ose gishta. Dridhja mund të ngjajë në numërimin e monedhave metalike apo lojën me tableta në dorë. Dora dridhet zakonisht në qetësi. Ajo mund të zbutet kur pacienti bën veprime me duar.
- Lëvizja e ngadalësuar, e njohur si bradikinezia. Me kalimin e kohës, sëmundja e Parkinsonit mund t’i ngadalësojë lëvizjet, duke i bërë detyrat apo veprimet e thjeshta të vështira dhe që kërkojnë kohë më të gjatë se zakonisht për t’i bërë. Hapat mund të bëhen më të shkurtër gjatë ecjes. Mund të jetë e vështirë të ngrihet nga karrigia. Këmbët mund të tërhiqen ose ngatërrohen gjatë përpjekjes për të ecur.
- Muskujt e ngurtë – rigjiditeti. Ngurtësia e muskujve mund të ndodhë në çdo pjesë të trupit. Muskujt e ngurtësuar mund të jenë të dhimbshëm dhe të kufizojnë gamën e lëvizjeve.
- Qëndrimi dhe ekuilibri i dëmtuar. Qëndrimi në këmbë të bëhet i përkulur. Mund të shfaqen rrëzimet apo problemetme ekuilibrin si pasojë e sëmundjes së Parkinsonit.
- Humbja e lëvizjeve automatike. Mund të pakësohet aftësia për të kryer lëvizje të pavetëdijshme, duke përfshirë buzëqeshjen ose lëkundjen e krahëve gjatë ecjes.
- Ndryshimet e të folurit.Të folurit mund të jetë më monoton sesa të ketë modelet e zakonshme të të folurit.
- Ndryshimet e shkrimit. Mund të bëhet e vështirë për të shkruar dhe shkrimi paraqitet me shkronja të përmasave që shkojnë duke u zvogëluar.
SHKAQET
Në sëmundjen e Parkinsonit, qelizat nervore të quajtura neurone gradualisht dëmtohen ose vdesin. Shumë nga simptomat e Parkinsonit janë për shkak të humbjes së neuroneve që prodhojnë një neurotransmiter kimik të quajtur dopaminë. Kur nivelet e dopaminës ulen, shkaktohet aktivitet i parregullt i trurit, duke çuar në probleme me lëvizjen dhe simptoma të tjera të sëmundjes së Parkinsonit.
Shkaku i sëmundjes së Parkinsonit është i panjohur, por disa faktorë duket se luajnë rol, duke përfshirë:
- Gjenet. Studiuesit kanë identifikuar ndryshime specifike gjenetike që mund të shkaktojnë sëmundjen e Parkinsonit. Por këto janë të rralla, përveç rasteve me shumë anëtarë të familjes të prekur nga sëmundja e Parkinsonit. Megjithatë, disa variacione të gjeneve duket se e rrisin rrezikun e sëmundjes së Parkinsonit, por me një rrezik relativisht të vogël të sëmundjes së Parkinsonit për secilin prej këtyre shënuesve gjenetikë.
- Shkaqet mjedisore. Ekspozimi ndaj disa toksinave ose faktorëve mjedisorë mund të rrisë rrezikun e sëmundjes së Parkinsonit të mëvonshëm, por rreziku është i vogël. Studiuesit gjithashtu kanë vërejtur se shumë ndryshime ndodhin në trurin e njerëzve me sëmundjen e Parkinsonit, megjithëse nuk është e qartë pse ndodhin këto ndryshime. Këto ndryshime përfshijnë:
- Prania e trupave Lewy. Grumbullimet e substancave specifike brenda qelizave të trurit janë shënues mikroskopikë të sëmundjes së Parkinsonit. Këta quhen trupa Lewy dhe studiuesit besojnë se këto trupa mbajnë një të dhënë të rëndësishme për shkakun e sëmundjes së Parkinsonit.
- Alfa-sinukleina e gjetur brenda trupave Lewy. Megjithëse shumë substanca gjenden brenda trupave Lewy, shkencëtarët besojnë se e rëndësishme është proteina natyrale dhe e përhapur e quajtur alfa-sinukleina, e quajtur edhe a-sinukleina. Gjendet në të gjithë trupat Lewy në një formë të grumbulluar që qelizat nuk mund të shpërbëhen. Ky është aktualisht një fokus i rëndësishëm në mesin e studiuesve të sëmundjes së Parkinsonit. Studiuesit kanë gjetur proteinën alfa-sinukleinë të grumbulluar në lëngun kurrizor të njerëzve që më vonë zhvillojnë sëmundjen e Parkinsonit.
FAKTORËT E RREZIKUT
Faktorët e rrezikut për sëmundjen e Parkinsonit përfshijnë:
- Mosha. Të rinjtë rrallë preken nga sëmundja e Parkinsonit. Zakonisht fillon në jetën e mesme ose të vonë, dhe rreziku rritet me moshën. Njerëzit zakonisht e zhvillojnë sëmundjen rreth moshës 60 vjeç ose më të vjetër. Nëse një i ri e ka sëmundjen e Parkinsonit, këshillimi gjenetik mund të jetë i dobishëm në marrjen e vendimeve për planifikimin familjar. Puna, situatat sociale dhe efektet anësore të ilaçeve janë gjithashtu të ndryshme nga ato të një personi të moshuar me sëmundjen e Parkinsonit dhe kërkojnë konsiderata të veçanta.
- Trashëgimia. Të kesh një të afërm të afërt me sëmundjen e Parkinsonit rrit shanset për zhvillim të sëmundjes. Megjithatë, rreziqet janë ende të vogla nëse nuk keni shumë të afërm në familjen tuaj me sëmundjen e Parkinsonit.
- Gjinia. Burrat kanë më shumë gjasa të zhvillojnë sëmundjen e Parkinsonit sesa gratë.
- Ekspozimi ndaj toksinave. Ekspozimi i vazhdueshëm ndaj herbicideve dhe pesticideve mund të rrisë pak rrezikun e sëmundjes së Parkinsonit.
KOMPLIKIMET
Sëmundja e Parkinsonit shoqërohet shpesh nga këto probleme shtesë, të cilat mund të trajtohen:
- Demenca. Humbja e aftësive njohëse dhe intelektuale zakonisht ndodhin në fazat e mëvonshme të sëmundjes së Parkinsonit. Probleme të tilla njohëse zakonisht nuk ndihmohen nga ilaçet.
- Depresioni dhe ndryshimet emocionale. Depresioni mund të paraqitet në fazat shumë të hershme. Marrja e trajtimit për depresionin mund ta bëjë më të lehtë trajtimin e sfidave të tjera të sëmundjes së Parkinsonit. Mund të përjetohen ndryshime të tjera emocionale, të tilla si frika, ankthi ose humbja e motivimit. Mjeku mund të japë ilaçe për të trajtuar këto simptoma.
- Probleme me gëlltitjen. Mund të paraqiten vështirësi me gëlltitjen ndërsa gjendja e sëmundjes përparon. Pështyma mund të grumbullohet për shkak të gëlltitjes së ngadaltë, duke çuar në pneumoni.
- Probleme me përtypjen dhe të ngrënit. Sëmundja e Parkinsonit në fazën e vonë prek muskujt në gojë, duke e bërë të vështirë përtypjen. Kjo mund të çojë në mbytje dhe ushqyerje të dobët.
- Problemet e gjumit dhe çrregullimet e gjumit. Njerëzit me sëmundjen e Parkinsonit shpesh kanë probleme me gjumin, duke përfshirë zgjimin e shpeshtë gjatë natës, zgjimin herët ose rënien në gjumë gjatë ditës. E shpeshtë është paraqitja e çrregullimit të gjumit të fazës REM. Ilaçet mund ta përmirësojnë gjumin.
- Problemet e fshikëzës urinare. Sëmundja e Parkinsonit mund të shkaktojë probleme të fshikëzës urinare, duke përfshirë paaftësinë për të kontrolluar urinën ose vështirësinë në urinim.
- Kapsllëk. Shumë njerëz me sëmundjen e Parkinsonit zhvillojnë kapsllëk, kryesisht për shkak të një trakti tretës më të ngadaltë.
- Problemet e tjera. Presioni i gjakut ndryshon. Personat e prekur mund të ndihen të trullosur kur qëndrojnë në këmbë për shkak të rënies së papritur të presionit të gjakut (hipotension ortostatik). Mund të keni probleme me shqisën tuaj të nuhatjes. Mund të keni vështirësi në identifikimin e aromave të caktuara ose ndryshimin midis aromave. Shumë njerëz me sëmundjen e Parkinsonit humbin energjinë dhe përjetojnë lodhje, veçanërisht më vonë gjatë ditës. Shkaku nuk dihet gjithmonë. Disa njerëz përjetojnë dhimbje, qoftë në zona të veçanta të trupit të tyre ose në të gjithë trupin e tyre. Disa pacientë vërejnë një ulje të libidos ose të performancës seksuale.
PARANDALIMI
Meqë shkaku i Parkinsonit është i panjohur, nuk ka mënyra të provuara për të parandaluar sëmundjen. Disa kërkime kanë treguar se ushtrimet e rregullta aerobike mund të zvogëlojnë rrezikun e sëmundjes së Parkinsonit. Disa kërkime të tjera kanë treguar se njerëzit që konsumojnë kafeinë - e cila gjendet në kafe, çaj dhe kola - sëmuren nga sëmundja e Parkinsonit më rrallë se ata që nuk e pinë atë. Çaji jeshil gjithashtu lidhet me një rrezik të reduktuar të zhvillimit të sëmundjes së Parkinsonit. Megjithatë, ende nuk dihet nëse kafeina mbron nga sëmundja e Parkinsonit apo është e lidhur në ndonjë mënyrë tjetër. Aktualisht nuk ka prova të mjaftueshme për të sugjeruar se pirja e pijeve me kafeinë mbron nga Parkinsoni.
DIAGNOZA
Aktualisht, nuk ka një test specifik për ta diagnostikuar sëmundjen e Parkinsonit. Diagnoza bëhet nga neurologu. Diagnoza e sëmundjes bazohet në historinë mjekësore, shqyrtimin e simptomave dhe ekzaminimin neurologjik e fizik. Mund të sugjerohet tomografia e kompjuterizuar e njohur si SPECT apo DAT. Megjithëse kjo mund të ndihmojë në mbështetjen e dyshimit për sëmundjen e Parkinsonit, janë simptomat dhe rezultatet e ekzaminimit neurologjik që përfundimisht përcaktojnë diagnozën e saktë. Mund të kërkohen teste laboratorike, si analizat e gjakut, për t’i përjashtuar shkaqet e tjera që mund të shkaktojnë simptomat e ngjashme me parkinsonizmin. Testet imazherike - të tilla si MRI, ultratingulli i trurit dhe skanimi PET - gjithashtu mund të përdoren për të ndihmuar në përjashtimin e çrregullimeve të tjera. Testet imazherike nuk janë veçanërisht të dobishme për diagnostikimin e sëmundjes së Parkinsonit. Përveç ekzaminimit, mund të jepet karbidopa-levodopa për testim. Duhet të jepet një dozë e mjaftueshme për ta dëshmuar dobinë, pasi marrja e dozave të ulëta mund të mbetet pa efekt dhe të shkaktojë përshtypje të gabuar. Përmirësimi i dukshëm me këtë ilaç shpesh do ta konfirmojë diagnozën e sëmundjes së Parkinsonit. Ndonjëherë duhet kohë për ta diagnostikuar sëmundjen e Parkinsonit. Profesionistët e kujdesit shëndetësor mund të rekomandojnë takime të rregullta pasuese me neurologë të trajnuar për çrregullimet e lëvizjes për të vlerësuar gjendjen dhe simptomat me kalimin e kohës dhe për ta diagnostikuar sëmundjen e Parkinsonit.
MJEKIMI
Sëmundja e Parkinsonit nuk mund të shërohet, por ilaçet mund të ndihmojnë në kontrollimin e simptomave, shpesh në mënyrë dramatike. Në disa raste më të avancuara, mund të këshillohet kirurgjia. Mjeku mund të rekomandojë ndryshime në stilin e jetës, veçanërisht ushtrimet aerobike të vazhdueshme. Në disa raste, terapia fizikale është e rëndësishme. Logopedi mund të ndihmojë në përmirësimin e problemeve të të folurit.
MEDIKAMENTET
Ilaçet mund të ndihmojnë në menaxhimin e problemeve me ecjen, lëvizjen dhe dridhjen. Këto ilaçe e rrisin nivelin e dopaminës në gjak. Njerëzit me sëmundjen e Parkinsonit kanë nivele të ulëta të dopaminës në tru. Megjithatë, dopamina nuk mund të jepet drejtpërdrejt sepse nuk mund të kalojë barrierën për depërtim në tru. Pacienti mund të ketë përmirësim të ndjeshëm të simptomave pas fillimit të trajtimit të sëmundjes së Parkinsonit. Megjithatë, me kalimin e kohës, përfitimi nga ilaçi shpesh zvogëlohet ose bëhet më pak i qëndrueshëm.
Barnat përfshijnë:
Karbidopa-levodopa. Levodopa, ilaçi më efektiv për sëmundjen e Parkinsonit, është një kimikat natyral që kalon në tru përmes karbidopës dhe shndërrohet në dopaminë.
- Levodopa është e kombinuar me karbidopan, e cila e mbron levodopën nga shndërrimi i hershëm në dopaminë jashtë trurit. Kjo parandalon ose pakëson efektet anësore, siç është mundimi i lukthit.
- Efektet anësore mund të përfshijnë mundimin ose marramendjen gjatë qëndrimit në këmbë – hipotension ortostatik.
- Pas vitesh, derisa sëmundja përparon, përfitimi nga levodopa mund të zvogëlohet.
- Gjithashtu, mund të paraqiten lëvizje të pavullnetshme të njohura si diskinezi pas marrjes së dozave më të larta të levodopas. Doza mund të zvogëlohet ose të ndryshohet intervali i marrjes së dozave me qëllim të kontrollimit të efekteve anësore. Nëse nuk rekomandohet ndryshe, karbidopa-levodopa merret në lukthin bosh. Infuzioni administrohet përmes një tubi ushqimor që e dërgon ilaçin në formë xheli direkt në zorrën e hollë. Është për pacientët me sëmundje më të avancuar, të cilët ende i përgjigjen karbidopa-levodopës, por që kanë shumë luhatje në përgjigjen e tyre. Për shkak se ajo injektohet vazhdimisht, nivelet në gjaktë dy ilaçeve mbeten konstante. Vendosja e tubit kërkon një procedurë të vogël kirurgjikale. Rreziqet që lidhen me mbajtjen e tubit përfshijnë rënien e tubit ose infeksionet në vendin e infuzionit. Ky lloj medikamenti aktualisht nuk gjendet në Kosovë.
Agonistët e dopaminës. Ndryshe nga levodopa, agonistët e dopaminës nuk metabolizohen në dopaminë. Në vend të kësaj, ato imitojnë efektet e dopaminës në tru. Nuk janë aq efektive sa levodopa në trajtimin e simptomave. Megjithatë, kohëzgjatja e trajtimit me to mund të jetë më e gjatë dhe mund të përdoren me levodopan për ta zbutur efektin e saj luhatës në kontrollimin e simptomave. Agonistët e dopaminës përfshijnë pramipeksolin dhe ropinirolin. Disa nga efektet anësore të agonistëve të dopaminës janë si efektet anësore të karbidopa-levodopas. Por ato gjithashtu mund të përfshijnë halucinacione, përgjumje dhe sjellje kompulsive si hiperseksualiteti, bixhozi dhe ngrënia e tepërt.
Inhibitorët e monoamin-oksidazës B (MAO B). Këto barna përfshijnë selegilinin, rasagilinin dhe safinamidin. Ato ndihmojnë në parandalimin e copëtimit të dopaminës në tru duke e inhibuar enzimën e trurit monoamin-oksidazën B. Efektet anësore mund të jenë dhimbjae kokës, mundimi dhe pagjumësia. Kur i shtohen karbidopa-levodopas, këto barna rrisin rrezikun e halucinacioneve. Këto barna nuk përdoren shpesh në kombinim me shumicën e antidepresantëve ose me ilaçe të caktuara kundër dhimbjeve për shkak të reaksioneve potencialisht serioze, por të rralla.
Inhibitorët e katekol-O-metiltransferazës (COMT). Entakaponi dhe opikaponi janë barnat kryesore nga kjo klasë. Këto ilaçe e zgjasin lehtë efektin e terapisë me levodopa duke e bllokuar një enzimë që e zbërthen dopaminën. Efektet anësore, duke përfshirë një rrezik të shtuar të lëvizjeve të pavullnetshme të quajtura diskinezi, vijnë kryesisht nga efekt i shtuar i levodopas. Efekte të tjera anësore janë diarrea, nauzea ose të vjellat. Tolkaponi është një tjetër inhibitor COMT që përshkruhet rrallë për shkak të rrezikut të dëmtimit serioz të mëlçisë dhe dështimit të saj.
Antikolinergjikët. Këto ilaçe janë përdorur për shumë vite për të ndihmuar në kontrollin e dridhjeve të lidhura me sëmundjen e Parkinsonit. Ekzistojnë disa ilaçe antikolinergjike, duke përfshirë benztropinën dhe triheksifenidilin. Megjithatë, përfitimet e tyre modeste shpesh kompensohen nga efektet anësore të tilla si kujtesa e dëmtuar, konfuzioni, halucinacionet, kapsllëku, tharja e gojës dhe urinimi i dëmtuar.
Amantadini. Amantadini mund të përshkruhet si i vetëm, për të ofruar lehtësim afatshkurtër të simptomave të sëmundjes së Parkinsonit në fazën fillestare të butë. Gjithashtu mund të jepet me terapinë me karbidopa-levodopa gjatë fazave të mëvonshme të sëmundjes së Parkinsonit për t’i kontrolluar lëvizjet e pavullnetshme të quajtura diskinezi. Efektet anësore mund të përfshijnë ndryshimine ngjyrës së lëkurës, ënjtje të kyçeve të këmbëve ose halucinacione.
Antagonistët e receptorit të adenozinës (antagonistët e receptorit A2A). Këto barna i kanë për cak zonat në tru që rregullojnë përgjigjen ndaj dopaminës dhe mundësojnë lirimin më të madh të saj. Istradefilini është një nga barnat antagoniste të A2A.
Nuplazidi. Ky medikament përdoret për t’i trajtuar halucinacionet dhe deluzionet që mund të ndodhin me sëmundjen e Parkinsonit.
PROCEDURAT KIRURGJIKALE
Stimulimi i thellë i trurit. Në stimulimin e thellë të trurit - "Deep Brain Stimulation" (DBS), kirurgët implantojnë elektroda në një pjesë specifike të trurit. Elektrodat janë të lidhura me një gjenerator të implantuar në gjoks pranë kockës së klavikulës. Gjeneratori dërgon pulse elektrike në tru dhe mund t’izbusë simptomat e sëmundjes së Parkinsonit. Kirurgjia përfshin rreziqe, sikur që janë infeksionet, insulti iskemik në tru ose hemorragjia e tij. Disa njerëz përjetojnë probleme me sistemin DBS ose kanë komplikime për shkak të stimulimit. Stimulimi i thellë i trurit u ofrohet më shpesh njerëzve me sëmundje të avancuar të Parkinsonit, të cilët kanë përgjigje të paqëndrueshme ndaj levodopës. DBS-ja mund t’i stabilizojë luhatjet e e simptomave që manifestohen nga ilaçet, t’i zvogëlojë ose ndalojë lëvizjet e pavullnetshme të quajtura diskinezi, tapakësojë dridhjen, të zvogëlojë ngurtësinë dhe t’i përmirësojë lëvizjet. DBS-ja është efektive për kontrollin e ndryshimit të përgjigjes ndaj levodopës ose për kontrollin e diskinezisë që nuk përmirësohet me rregullimet e ilaçeve. Sidoqoftë, DBS-ja nuk është e dobishme për rastet që nuk reagojnë ndaj levodopas, me përjashtim të dridhjes. Dridhja mund të kontrollohet nga DBS-ja edhe nëse ajo nuk i përgjigjet mirë trajtimit me levodopa. Megjithëse DBS-ja mund të ofrojë përfitime të qëndrueshme për simptomat e Parkinsonit, ai nuk e pengon përparimin apo përkeqësimin e sëmundjes së Parkinsonit.
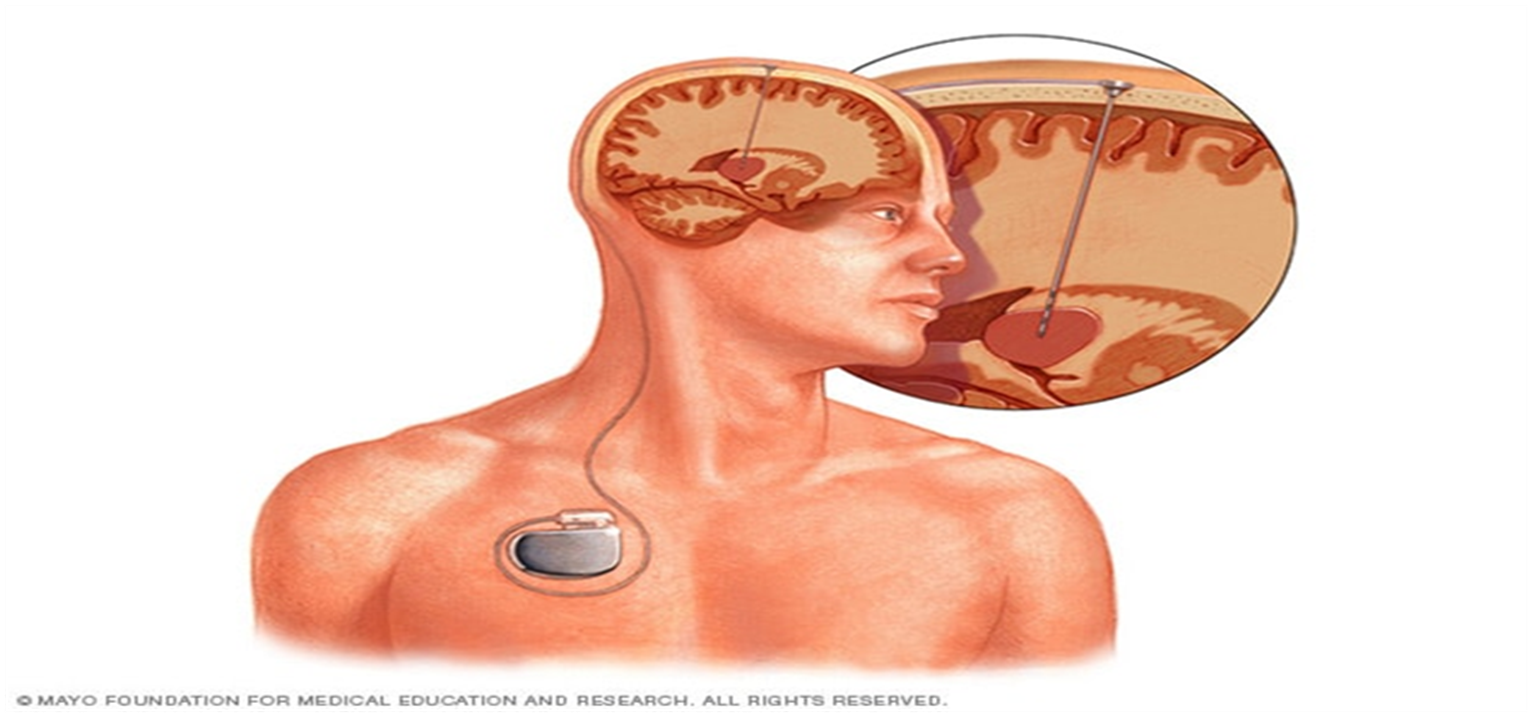
TRAJTIME TË AVANCUARA
Ekografia e fokusuar e drejtuar nga MRI-ja (MRgFUS) është një trajtim minimal invaziv që ka ndihmuar disa njerëz me sëmundjen e Parkinsonit për menaxhimin e dridhjeve. Ultratingulli udhëhiqet nga një MRI në zonën në tru ku fillojnë dridhjet. Valët e ultrazërit me temperaturë shumë të lartë i djegin zonat që kontribuojnë në dridhjet.
USHQIMI I SHËNDETSHËM
Derisa asnjë ushqim apo kombinim ushqimesh nuk është vërtetuar se ndihmon në sëmundjen e Parkinsonit, disa ushqime mund të ndihmojnë në lehtësimin e disa simptomave. Për shembull, ngrënia e ushqimeve të pasura me fibra dhe konsumimi i lëngjeve mund të ndihmojë në parandalimin e kapsllëkut që është i zakonshëm në sëmundjen e Parkinsonit. Një dietë e ekuilibruar gjithashtu siguron lëndë ushqyese, të tilla si acidet yndyrore omega-3, që mund të jenë të dobishme për sëmundjen e Parkinsonit.
USHTRIMET
Ushtrimet fizike mund ta rrisin forcën, fleksibilitetin dhe ekuilibrin e muskujve. Ato gjithashtu mund ta përmirësojnë mirëqenien dhe të zvogëlojnë depresionin ose ankthin. Puna me fiziatrin dhe fizioterapeutin mundëson mësimin e një programi ushtrimesh. Mund të provohen ushtrime të tilla si ecja, noti, kopshtaria, kërcimi, gjimnastika në ujë.
Sëmundja e Parkinsonit mund ta dëmtojë ekuilibrin, duke e bërë të vështirë ecjen e zakonshme. Këto sugjerime gjithashtu mund të ndihmojnë: Mundohuni të mos lëvizni shumë shpejt. Synoni që thembra juaj ta prek së pari dyshemenë kur jeni duke ecur. Nëse vëreni se keni mundim, ndaloni dhe kontrolloni qëndrimin tuaj. Është më mirë të qëndroni drejt. Shikoni përpara jush, jo drejtpërdrejt poshtë, ndërsa ecni.
SHMANGIA E RËNIEVE
Në fazat e mëvonshme të sëmundjes, rrëzimet bëhen të shpeshta. Ekuilibri mund të humbet vetëm nga një shtytje ose përplasje e vogël. Sugjerimet e mëposhtme mund të ndihmojnë: Bëni një kthesë në drejtim të kundërt në vend që ta rrotulloni trupin mbi këmbët tuaja. Shpërndani peshën tuaj në mënyrë të barabartë midis dy këmbëve dhe mos u përkulni. Shmangni mbajtjen e gjërave gjatë ecjes. Shmangni ecjen prapa.
AKTIVITETET E PËRDITSHME TË JETESËS
Aktivitetet e përditshme të jetesës – veshja, ngrënia, larja dhe të shkruarit – mund të jenë të vështira për njerëzit me sëmundjen e Parkinsonit. Një terapist profesionist mund të tregojë teknika që e bëjnë jetën e përditshme më të lehtë. Nëse ka probleme me të folurit, logopedi mund të jetë në gjendje të ndihmojë. Shumë njerëz me sëmundjen e Parkinsonit kanë vështirësi në të folur, si zë i ngadaltë dhe i dobët, probleme me bashkëtingëlloret, të folur të paqartë, zë të ulët që ka monotoni, me pak shprehje dhe heshtje të papërshtatshme.
MJEKËSIA ALTERNATIVE
Terapitë mbështetëse mund të ndihmojnë në lehtësimin e disa prej simptomave dhe komplikimeve të sëmundjes së Parkinsonit, siç janë dhimbja, lodhja dhe depresioni. Kur kryhen në kombinim me trajtimet klasike, këto terapi mund ta përmirësojnë cilësinë e jetës:
- Masazhi. Terapia e masazhit mund të zvogëlojë tensionin e muskujve dhe të nxisë relaksimin.
- Taichi. Një formë e lashtë e stërvitjes kineze, taichi, përdor lëvizje të ngadalta dhe rrjedhëse që mund ta përmirësojnë fleksibilitetin, ekuilibrin dhe forcën e muskujve. Taichi gjithashtu mund të ndihmojë në parandalimin e rënies. Disa forma të taichi janë të përshtatura për njerëzit e çdo moshe ose gjendjeje fizike. Një studim ka treguar se taichi mund ta përmirësojë ekuilibrin e njerëzve me sëmundjen e lehtë të Parkinsonit më shumë sesa stërvitjet me shtrirje dhe rezistencë.
- Joga. Në joga, lëvizjet dhe pozat e buta shtrirëse mund ta rrisin fleksibilitetin dhe ekuilibrin. Shumica e pozave mund të modifikohen për t'iu përshtatur aftësive fizike të pacientit.
- Teknika e Aleksandrit. Kjo teknikë – e cila fokusohet në qëndrimin e muskujve, ekuilibrin dhe të menduarit se si përdoren muskujt – mund ta zvogëlojë tensionin dhe dhimbjen e muskujve.
- Meditimi. Në meditim, reflektohet në heshtje dhe mendja përqendrohet në një ide ose imazh. Meditimi mund të zvogëlojë stresin dhe dhimbjen dhe të përmirësojë ndjenjën tuaj të mirëqenies.
- Terapia e kafshëve shtëpiake. Të kesh një qen ose mace mund të rrisë fleksibilitetin dhe lëvizjen dhe të përmirësojë shëndetin emocional.
- Teknikat e relaksimit. Këto praktika ndihmojnë në uljen e presionit të gjakut, reduktojnë rrahjet e zemrës dhe përmirësojnë tonin e muskujve.
PËRBALLIMI DHE MBESHTETJA
Të jetosh me një sëmundje kronike mund të jetë e vështirë dhe nuk është e pazakontë të ndiheni ndonjëherë të zemëruar, të dëshpëruar ose të dekurajuar. Sëmundja e Parkinsonit mund të jetë thellësisht frustruese pasi ecja, të folurit dhe madje edhe të ngrënit bëhen më të vështira dhe kërkojnë kohë. Depresioni është i zakonshëm tek njerëzit me sëmundjen e Parkinsonit, por ilaçet kundër depresionit mund të ndihmojnë në lehtësimin e simptomave të tij. Megjithëse miqtë dhe familja mund të jenë aleatët tuaj më të mirë, mirëkuptimi i njerëzve që e dinë se çfarë po kaloni mund të jetë veçanërisht i dobishëm. Për shumë njerëz me sëmundjen e Parkinsonit dhe familjet e tyre, një grup mbështetës mund të jetë burim i mirë për informacion praktik rreth sëmundjes së Parkinsonit. Gjithashtu, grupet ofrojnë një vend ku mund të gjeni njerëz që po kalojnë situata të ngjashme dhe mund t'ju mbështesin. Përpjekja për të mbajtur disa nga aktivitetet tuaja të zakonshme mund të jetë e dobishme. Synoni të bëni sa më shumë gjëra që mund të bëni përpara fillimit të sëmundjes së Parkinsonit. Përqendrohuni në të tashmen dhe përpiquni të mbani një qëndrim pozitiv. Shkruani çdo simptomë që po përjetoni, përfshirë ato që mund të duken të palidhura me arsyen për të cilën keni caktuar takimin. Shkruani informacionin kryesor personal, duke përfshirë çdo stres të madh ose ndryshim të fundit të jetës. Bëni një listë të të gjitha ilaçeve, vitaminave dhe suplementeve që po merrni.
REFERENCAT
https://www.mayoclinic.org/diseases-conditions/parkinsons-disease/diagnosis-treatment/drc-20376062
Përditësuar: Gusht 2024
Përgatiti: Dr. Muhamed Maliqi
Redaktoi: Ass. Dr. Blerim Myftiu
MIASTENIA GRAVIS
Miastenia gravis është sëmundje e rrallë kronike autoimune, neuromuskulore e cila bën që muskujt e vullnetshëm të dobësohen dhe të lodhen shpejt. Kjo ndodh kur komunikimi ndërmjet nervave dhe muskujve dëmtohet. Nga kjo sëmundje mund të preken njerëzit e çdo moshe, zakonisht gratë nën 40 vjeç dhe burrat mbi 60 vjeç. Edhepse është një sëmundje e pashërueshme, trajtimi mund të ndihmojë në lehtësimin e simptomave. Këto simptoma janë: dobësimi i muskujve të krahëve ose këmbëve, të parit e dyfishtë, rënia e kapakëve të syve dhe probleme me të folurit, përtypjen, gëlltitjen dhe frymëmarrjen. Shenja kryesore dalluese e miastenia gravis është dobësimi muskulor që përkeqësohet pas periudhave të aktivitetit dhe përmirësohet pas periudhave të pushimit. Më së shpeshti të përfshirë (por jo gjithmonë) në këtë çrregullim janë muskujt që kontrollojnë:
- Lëvizjen e syve dhe kapakëve të syrit
- Shprehjet e fytyrës
- Përtypjen
- Të folurit
- Gëlltitjen
Fillimi i çrregullimit mund të jetë i papritur dhe në fillim mund të mos dyshohet në miastenia gravis. Shkalla e dobësimit muskulor ndryshon shumë nga pacienti në pacient. Simptomat e më poshtme zakonisht ndërlidhen me miastenia gravis:
- Dobësim i muskujve të syrit (miastenia okulare)
- Rënia e njërit ose të dy kapakëve të syrit (ptoza)
- Të parit e paqartë ose të dyfishtë (diplopia)
- Ndryshim në shprehjet e fytyrës
- Vështirësi në gëlltitje
- Vështirësi dhe pengesa në frymëmarrje
- Çrregullim i të folurit (dizartria)
- Dobësim i krahëve, duarve, gishtave, këmbëve dhe qafës
Kush ka më shumë gjasa të sëmuret nga miastenia gravis?
Miastenia gravis prek si meshkujt ashtu edhe femrat dhe shfaqet në të gjitha grupet racore dhe etnike. Më së shpeshti i prek femrat nën moshën 40 vjeçare dhe meshkujt mbi moshën 60 vjeçare, por mund të shfaqet në çdo moshë, duke përfshirë fëmijërinë.
Miastenia gravis nuk është sëmundje e trashëguar dhe as ngjitëse. Mund të ndodhë që sëmundja të shfaqet te më shumë se një anëtar i së njëjtës familje. Megjithëse miastenia gravis paraqitet rrallë tek foshnjat, fetusi mund të marrë antitrupa nga nëna – njëgjendje e quajtur miastenia neonatale. Miastenia neonatale në pothuajse të gjitha rastet është e përkohshme dhe simptomat te fëmija i prekur zakonisht zhduken brenda dy deri në tre muajsh pas lindjes.
Shkaktarët e miastenia gravisit
Antitrupat – Nervat komunikojnë me muskujt duke liruar kimikate, të quajtura neurotransmetues, që lidhen në vende të caktuara në qelizat muskulore, të quajtura vendet e receptorit, në kryqëzimin apo sinapsën neuromuskulore. Te miastenia gravis, sistemi imunitar prodhon antitrupa që bllokojnë ose shkatërrojnë shumë nga vendet e receptorëve neuromuskularë për neurotransmetuesin e quajtur acetilkolinë. Duke pasur kështu më pak receptorë në dispozicion, muskujt marrin më pak sinjale nervore. Kjo shkakton dobësimin muskulor, karakteristikë e miastenia gravis. Antitrupat gjithashtu mund të bllokojnë një proteinë të receptorit specifik të muskujve të quajtur tirozinë-kinazë, e referuar si MuSK. Tirozinë-kinaza ndihmon në formimin e lidhjes neuromuskulore. Antitrupat kundër kësaj proteine mund të çojnë në shfaqjen e miastenia gravis. Antitrupat kundër një proteine tjetër, të quajtur proteina 4 e lidhur me lipoproteinën (LRP4), mund të luajnë një rol në shkaktimin e kësaj gjendjeje. Studiuesit kanë gjetur antitrupa të tjerë dhe numri i antitrupave të përfshirë ka të ngjarë të rritet me kalimin e kohës. Disa njerëz vuajnë nga miastenia gravis e cila nuk shkaktohet nga antitrupat që bllokojnë acetilkolinën, MuSK-un ose LRP4. Kjo quhet miastenia gravis seronegative, e njohur edhe si miastenia gravis me antitrupa negative. Studiuesit besojnë se ky lloj i miastenia gravis prapëseprapë vjen nga një problem me autoimunitetin, por antitrupat e përfshirë thjesht nuk janë gjetur ende.
Timusi – Është pjesë e sistemit imunitar. Kjo gjëndër ndodhet në pjesën e sipërme të gjoksit, nën kafazin e kraharorit. Studiuesit besojnë se gjëndra e timusit prodhon ose ndihmon në prodhimin e antitrupave që e bllokojnë acetilkolinën. Normalisht, ajo rritet gradualisht deri në pubertet dhe më pas zvogëlohet dhe zëvendësohet nga indi yndyror. Gjatë fëmijërisë, timusi luan një rol të rëndësishëm në zhvillimin e sistemit imunitar, ngase është përgjegjës për prodhimin e limfociteve T, një lloj specifik i qelizave të bardha të gjakut që mbron trupin nga viruset dhe infeksionet. Te personat e rritur me miastenia gravis, gjëndra e timusit mbetet e madhe (nuk zvogëlohet). Njerëzit me miastenia gravis zakonisht kanë grupe qelizash imune në gjëndrën e timusit dhe mund të zhvillojnë timoma (tumore të gjëndrës së timusit). Timomat janë më shpesh të padëmshme, por mund të bëhen kanceroze. Shkencëtarët besojnë se gjëndra e timusit mund të japë udhëzime të pasakta për zhvillimin e qelizave imune, duke bërë që sistemi imunitar të sulmojë qelizat dhe indet e veta dhe të prodhojë antitrupa të receptorit të acetilkolinës – duke vënë bazën për sulmin ndaj transmetimit neuromuskular.
Faktorët që mund ta përkeqësojnë miastenia gravisin janë:
- Lodhja.
- Sëmundjet tjera ose ndonjë infeksion.
- Ndërhyrjet kirurgjike.
- Stresi.
- Barnat - të tilla si: beta bllokuesit, glukonati i kinidinës, sulfati i kinidinës, kinina (Qualaquin), fenitoina (Dilantin), anestetikë të caktuar dhe disa antibiotikë.
- Shtatzënia.
- Cikli menstrual.
Simptomat e miastenia gravisit
Dobësimi muskulor i shkaktuar nga miastenia gravis përkeqësohet më shumë kur përdoren muskujt e prekur. Për shkak se simptomat zakonisht përmirësohen me pushim, dobësimi muskulor nuk është konstant. Megjithatë, simptomat kanë tendencë të përparojnë me kalimin e kohës. Ato zakonisht arrijnë shkallën më tërëndë brenda pak vitesh pas fillimit të sëmundjes. Miastenia gravis mund ta prekë cilindo nga muskujt e vullnetshëm të trupit por disa grupe muskujsh preken më shpesh se të tjerët.
Muskujt e syve
Te më shumë se gjysma e njerëzve që vuajnë nga miastenia gravis, simptomat e para shfaqen në sy. Këto simptoma janë:
- Rënia e njërit ose e të dy kapakëve të syrit, e quajtur ptozë.
- Shikimi i dyfishtë, i quajtur diplopi, i cili mund të jetë horizontal ose vertikal dhe përmirësohet ose tërhiqet kur njëri sy është i mbyllur.

Muskujt e fytyrës dhe të fytit
Tek rreth 15% të njerëzve me miastenia gravis, simptomat e para përfshijnë muskujt e fytyrës dhe të fytit. Këto simptoma manifestohen me:
- Vështirësinë në të folur. Të folurit mund të tingëllojë i ngadalësuar ose hundor (nazal), në varësi të muskujve të prekur.
- Vështirësinë në gëlltitje. Të ngrënit, të pirët ose marrja e barnave vështirësohet dhe ndonjëherë mund të ndodhë që, gjatë gëlltitjes lëngjet dalin nga hunda.
- Vështirësinë në përtypje. Muskujt që mundësojnë përtypjen mund të lodhen gjatëngrënies sëvaktit ushqimor. Kjo është veçanërisht e theksuar gjatë përtypjes së ushqimeve të vështira për t'u përtypur, si p.sh bifteku.
Muskujt e qafës dhe të gjymtyrëve
Miastenia gravis gjithashtu mund të shkaktojë dobësi në qafë, krahë dhe këmbë. Dobësia në këmbë mund të ndikojë në mënyrën e të ecurit. Muskujt e dobësuar të qafës e vështirësojnë mbajtjen e kokës.
Çrregullime tjera që shoqërojnë miastenia gravisin
Njerëzit me miastenia gravis kanë më shumë gjasa të kenë çrregullimet si në vijim:
- Gjëndra tiroide joaktive ose tepër aktive. Gjëndra tiroide e cila gjendet në qafë, sekreton hormone që e rregullojnë metabolizmin. Nëse tiroidja është joaktive, mund të paraqiten probleme në termorregullimin (jotolerimi i të ftohtit), shtimin në peshë dhe të tjera. Një tiroide tepër aktive mund të shkaktojë probleme në formë të ndjesisë së të nxehtit, rënies në peshë.
- Sëmundjet autoimune. Njerëzit me miastenia gravis kanë më shumë gjasa vuajnë nga sëmundjet autoimune, të tilla si artriti reumatoid ose lupusi.
Si diagnostikohet miastenia gravis?
Miastenia gravis mund të jetë e vështirë për t'u diagnostikuar dhe nevojiten disa testime. Zakonisht, mjeku i përgjithshëm do të marrë historinë dhe do të pyesë për simptomat. Përndryshe, oftalmologu, tek i cili ka mundësi të jeni vizituar, mund të ketë vënë re probleme të tilla si shikimi i dyfishtë ose rënia e kapakëve të syve dhe mund ta referojë pacientin te neurologu.
- Analizat e gjakut
Testi kryesor për miastenia gravis është analiza e gjakut ku kërkohet një lloj antitrupi, që e pengon dërgimin e sinjaleve midis nervave dhe muskujve. Nëse niveli i këtyre antitrupave është i lartëzakonisht do të thotë që keni miastenia gravis. Por, jo të gjithë pacientët me miastenia gravis do të kenë një nivel të lartë të antitrupave, veçanërisht nëse preken vetëm muskujt e syrit (miastenia okulare).
- Testet nervore
Neurologu mund të sugjerojë gjithashtu një test elektrik të nervave dhe muskujve.Ky test, i njohur si elektromioneurografi, realizohet me futjen e gjilpërave shumë të vogla në muskuj për të matur aktivitetin elektrik të tyre. Regjistrimet elektrike tregojnë nëse sinjalet e dërguara nga nervat në muskuj bien dhe regjistrohen potenciale gjithmonë më të vogla me stimulimet e njëpasnjëshme, shenjë emundshme e miastenia gravis.
- Skanimet
Tomografia e kompjuterizuar (TK) oseimazheria me rezonancë magnetike(MRI) e gjoksit bëhet për të parë nëse gjëndra e timusit është më e rritur se zakonisht ose nëse ka rritje jonormale (timoma).Ndonjëherë, mund të bëhet edhe një MRI e kokës për t’u siguruar që simptomat nuk janë shkaktuar nga një problem tjetër në tru.
- Testi me prostigminë
Nëse ende nuk është e qartë se çfarë i shkakton simptomat, neurologu mund të rekomandojë një test të quajtur testi meprostigminë.Ai e përfshin injektimin nën lëkurë të barit të quajtur prostigminë. Nëse vërehet përmirësim i përkohshëm iforcës së muskujve pas injektimit, ka të ngjarë që pacienti të ketëmiasteniagravis.Ky testimbëhet vetëm në ambient spitalor dhe nën mbikëqyrjene neurologut. Ekzaminimi neurologjik që kryen neurologu është thelbësor për diagnostikimin e miastenia gravisit. Gjatë vizitës neurologu do të ekzaminoj:
- Reflekset.
- Forcën muskulore.
- Tonusin muskulor.
- Shqisën e të prekurit dhe të parit.
- Koordinimin.
- Ekuilibrin
Trajtimi
Meqenëse miastenia gravis është sëmundje e pashërueshme, trajtimi ndikon që të ketë përmirësim të pasqyrës klinike dhe të ketë periudha pa simptoma (remision). Trajtime të ndryshme, të vetme ose të kombinuara, mund të ndihmojnë në përmirësimin e simptomave të miastenia gravis. Trajtimi varet nga mosha e pacientit, shpejtësia e përparimit të sëmundjes dhe shkalla e sëmundjes.
Medikamentet për trajtimin e miastenia gravis janë:
- Frenuesit e kolinesterazës. Barnat si piridostigmina (Mestinon, Regonal) përmirësojnë komunikimin midis nervave dhe muskujve. Këto barna mund të përmirësojnë tkurrjen e muskujve dhe rrisin forcën e muskujve tek disa persona. Merren disa herë në ditë, në formë tabletare. Efektet anësore të mundshme përfshijnë shqetësimet gastrointestinale, diarreja, nauzea si dhe djersitja dhe shtimi i sekretimit të pështymës.
- Kortikosteroidet. Kortikosteroidet si prednisoni (Encorton) zvogëlojnëpërgjigjen imunitare, duke e ulur aftësinë e prodhimit të antitrupave. Megjithatë, përdorimi i kortikosteroideve për një periudhë të gjatë kohore mund të çojë në efekte anësore serioze. Këto përfshijnë dobësimin e kockave, shtimin në peshë, diabetin dhe rrezikun e shtuar për infeksione.
- Imunosupresorët. Këto barna të përfshijnë azatioprinin (Imuran), mikofenolatmofetilin, ciklosporinën,metotreksatin dhe merren si tableta çdo ditë.Efektet e para të këtyre barnave mund të vërehen pas një kohe të përdorimit. Për azatioprininduhen tre muaj kurse për mikofenolatingjashtë muaj.Efektet anësore mund të përfshijnë: rritjene rrezikut për t'u prekur nga infeksionet, humbjen e oreksit dhelodhjen. Gjithashtu duhet të bëhen analiza të rregullta tëgjakut për të kontrolluar sasinë e ilaçit në trup.
- Nëse këto barna i mbajnë simptomat nën kontroll për një kohë të gjatë (zakonisht vite), mund të jetë e mundur që përfundimisht të ndërpritet marrja e tyre.
- Plazmafereza. Kjo procedurë përdor një proces filtrimi të ngjashëm me dializën. Gjaku futet nëaparatin i cili i largon antitrupat që e bllokojnë transmetimin e sinjaleve nga mbaresat nervore në muskuj. Megjithatë, efektet e mira nga kjo procedurë zakonisht zgjasin vetëm disa javë.
- Imunoglobulina intravenoze (IVIg). Kjo terapi i siguron trupit antitrupa, të cilët ndryshojnë përgjigjen e sistemit imunitar. Përfitimet zakonisht shihen pas më pak se një javë dhe mund të zgjasin 3 deri në 6 javë
- Antitrupat monoklonalë. Rituksimabi dhe Eculizumabi janë barna që jepen përmes venës dhe zakonisht përdoren kur trajtimet e tjera nuk funksionojnë.
Ndërhyrja kirurgjike
Disa pacientë me miastenia gravis kanë tumor në gjëndrën e timusit. Në këto raste duhet të bëhet një ndërhyrje kirurgjike për të hequr tumorin (timoma) nga gjëndrae timusit. Kjo procedurë quhet timektomi. Heqja e timusit edhe nëse nuk ka tumor mund të përmirësojë simptomat e miastenisë.
Çka është kriza miastenike?
Kriza miastenike është komplikimi i rëndë i miastenia gravisit. Është urgjencë mjekësore që ndodh kur muskujt që e kontrollojnë frymëmarrjen dobësohen deri në pikën ku nevojitet asistim me ventilator për të marrë frymë. Mund të shkaktohet nga infeksioni, stresi, operacioni ose reagimi negativ ndaj ilaçeve. Përafërsisht 15 deri në 20 për qind e njerëzve me miastenia gravis përjetojnë të paktën një krizë miastenike dhe deri në 50 për qind mund të mos kenë asnjë shkaktar të dukshëm për krizën e tyre miastenike. Në këto raste nevojitet trajtim urgjent spitalor dhe shpesh ndihmë mekanike për frymëmarrje.
Këshilla për pacientët
Për t'ju ndihmuar të shfrytëzoni sa më shumë energjinë dhe të përballeni me simptomat e miastenia gravis:
- Rregulloni rutinën e të ngrënit. Mundohuni të hani kur keni forcë të mirë të muskujve. Përtypeni ngadalë ushqimin dhe bëni pauzë midis kafshatave. Mund ta keni më të lehtë të hani vakte të vogla disa herë në ditë. Gjithashtu, provoni të hani kryesisht ushqime të buta dhe shmangni ushqimet që kërkojnë më shumë përtypje, si frutat ose perimet e papërpunuara.
- Përdorni masat paraprake të sigurisë në shtëpi. Instaloni shufra kapëse ose kangjella në vendet ku keni nevojë për mbështetje, si p.sh. pranë vaskës ose pranë shkallëve. Mbani dyshemetë e pastra dhe lëvizni qilimat që rrëshqasin. Jashtë shtëpisë tuaj, mbani shtigjet, trotuaret dhe rrugët me rrugë të pastruara nga gjethet, bora dhe mbeturinat e tjera në të cilat mund të pengoheni.
- Përdorni pajisje elektrike dhe mjete elektrike. Për të kursyer energjinë tuaj, provoni të përdorni një furçë dhëmbësh elektrike, hapëse elektrike të kanaçeve dhe mjete të tjera elektrike për të kryer detyrat.
- Përdorni peceta për të mbyllur syrin. Provoni të përdorni një për të shkruar, lexuar ose parë televizor.
- Planifikoni. Nëse keni punë, blerje ose punë për të bërë, planifikoni aktivitetin për kohën kur keni më shumë energji.
- Përballja me miasteniagravis mund të jetë e vështirë për ju dhe më të dashurit tuaj. Stresi mund ta përkeqësojë miastenia gravis, ndaj gjeni mënyra për t'u çlodhur. Kërkoni ndihmë kur ju nevojitet.
- Mësoni sa më shumë që mundeni për gjendjen tuaj dhe edukojini të afërmit. Konsideroni anëtarësimin në grupe mbështetëse, ku mund të takoni njerëz që kuptojnë se çfarë po kaloni ju dhe anëtarët e familjes suaj.
Pacientët me miastenia gravis, mbani mend! Muskujt mund ti keni te dobët por zemrën e keni të fortë!
Përgatiti: Dr. Pranvera Bytyçi
Redaktoi: Ass. Dr. Blerim Myftiu
Burimet: www.mayoclinic.org, www.nhs.uk, www.ninds.nih.gov, www.hopkinsmedicine.org
Përditësuar: Gusht 2024
Insulti cerebrovaskular (insulti iskemik akut apo goditja/sulmi në tru)
Insulti cerebrovaskular ka shumë terme të cilat përdoren në praktikën dhe komunikimin e përditshëm. Sulmi në tru, goditja në tru, pika në tru, insulti iskemik akut apo ndonjëherë shkurtesa ICV u referohen të njëjtit kuptim. Kjo ngjarje ndodh kur furnizimi me gjak në një pjesë të trurit ndërpritet ose zvogëlohet, duke parandaluar që indet e trurit të marrin oksigjen dhe lëndë ushqyese. Qelizat e trurit fillojnë të vdesin brenda pak minutash. Duke qenë një urgjencë mjekësore trajtimi i menjëhershëm është thelbësor si dhe intervenimi i shpejtë mund të zvogëlojë dëmtimin e trurit dhe komplikimet e tjera.
Nëse dyshoni se ju ose dikush afër jush mund të jetë duke pësuar një goditje në tru, kushtojini vëmendje të veçantë kohës kur kanë filluar simptomat. Disa opsione trajtimi janë më efektive kur jepen menjëherë pas fillimit të një goditjeje.
Shenjat dhe simptomat e goditjes në tru janë:
- Vështirësi në të folur dhe të kuptuarit e asaj që thonë të tjerët.
- Paralizë ose mpirje e fytyrës, krahut ose e këmbës. Ju mund të zhvilloni mpirje, dobësi ose paralizë të papritur në fytyrë, krah ose këmbë. Kjo shpesh prek vetëm njërën anë të trupit. Mundohuni të ngrini të dy krahët mbi kokë në të njëjtën kohë, nëse njëri krah fillon të bie, ju mund të jeni duke pësuar një goditje në tru. Gjithashtu, njëra anë e gojës suaj mund të ulet më poshtë kur përpiqeni të buzëqeshni.
- Probleme me shikimin në njërin ose të dy sytë. Mund të keni papritmas shikim të turbullt ose errësim në njërin ose të dy sytë, ose mund të shihni dyfish.
- Dhimbje koke. Një dhimbje koke e papritur dhe e rëndë, e cila mund të shoqërohet me të vjella, marramendje ose vetëdije të çrregulluar, mund të jetë shenjë se jeni duke pasur një goditje në tru.
- Probleme me ecjen. Mund të ngatërroheni gjatë të ecurit, ta humbni ekuilibrin, të keni marramendje të papritur ose humbje të koordinimit.
Kur të thërras ndihmën e shpejtë/kërkoj ndihmë mjekësore?
Kërkoni kujdes të menjëhershëm mjekësor nëse vëreni ndonjë shenjë ose simptomë të një goditjeje në tru, edhe nëse ato duket se vijnë dhe shkojnë ose zhduken plotësisht. Ju mund t’i bëni personit afër jush një kontroll të shpejtë si më poshtë:
- Fytyra. Kërkoji që të buzëqeshë. A bie më poshtë njëri kënd i gojës për dallim nga tjetri?
- Krahët. Kërkoji që t’i ngrit të dy krahët. A po fillon të ulet njëri krah poshtë? Apo tjetri krah nuk mund të ngrihet?
- Komunikimi. Kërkojini që të përsërisë një frazë të thjeshtë. A është fjalimi i tij ose i saj i paqartë apo i çuditshëm?
- Koha. Nëse vëreni ndonjë nga këto shenja, telefononi menjëherë 194.
Telefononi menjëherë 194 ose numrin tuaj të urgjencës lokale. Mos prisni të shihni nëse simptomat tërhiqen. Çdo minutë ka rëndësi. Sa më gjatë të mos trajtohet një goditje, aq më i madh është potenciali për dëmtim dhe paaftësi të trurit.
Nëse jeni me dikë që dyshoni se ka një goditje në tru, qëndroni afër ndërsa prisni ndihmën e shpejtë.
Çfarë është një atak iskemik kalimtar?
Një atak iskemik kalimtar (TIA) e njohur ndryshe edhe si goditje e vogël e trurit – konsiderohet nëse simptomat e ngjashme me ato të sulmit në tru zgjasin më shkurt se 24 orë. Nuk shkakton dëme të përhershme dhe shkaktohet nga një ulje e përkohshmee furnizimit me gjak të një pjese të trurit, e cila mund të zgjasë edhe vetëm pesë minuta.
Ashtu si një goditje iskemike, një TIA ndodh kur një tromb gjaku e redukton ose bllokon rrjedhjen e gjakut në një pjesë të sistemit nervor. TIA e rrit rrezikun për të pasur një goditje të plotë më vonë.
Kërkoni ndihmë mjekësore edhe nëse mendoni se keni pasur një TIA sepse simptomat tuaja janë përmirësuar.
Cilët janë faktorët e rrezikut?
Shumë faktorë mund të rrisin rrezikun e goditjes në tru. Faktorët e rrezikut që kanë mundësi të trajtohen janë:
- Faktorët e stilit të jetesës (mbipesha ose obeziteti; joaktiviteti fizik; alkoolizmi; përdorimi i drogave ilegale si kokaina dhe metamfetamina)
- Faktorët mjekësorë (presioni i lartë i gjakut; pirja e duhanit ose ekspozimi ndaj tymit të dorës së dytë; kolesteroli i lartë; diabeti; apnea obstruktive e gjumit; sëmundjet kardiovaskulare duke përfshirë insuficiencën e zemrës, patologjitëe zemrës, infeksioni ose ritmii parregullt siç është fibrilacioniatrial; historia personale ose familjare e goditjes në tru, sulmit në zemër ose sulmit ishemik kalimtar, infektimi me Covid-19)
Faktorë të tjerë që lidhen me një rrezik të lartë të goditjes në tru janë, dhe të cilat janë të pamodifikueshme janë:
- Mosha – njerëzit e moshës 55 vjeç ose më të vjetër kanë një rrezik më të lartë për goditje në tru sesa të rinjtë.
- Raca ose përkatësia etnike – afrikano-amerikanë dhe hispanikët kanë rrezik më të lartë të goditjes në tru sesa njerëzit e racave ose etnive të tjera.
- Gjinia –burrat kanë një rrezik më të lartë për goditje në tru sesa gratë. Gratë zakonisht janë të moshave më të vjetra kur kanë goditje në tru dhe kanë më shumë gjasa të vdesin nga goditjet sesa burrat.
- Hormonet –përdorimii kontraceptive ose terapive hormonale.
Cilat janë komplikimet?
Një goditje në tru nganjëherë mund të shkaktojë paaftësi të përkohshme ose të përhershme, në varësi të asaj se sa kohë trurit i mungon furnizimi me gjakut dhe cila pjesë është prekur. Komplikimet mund të përfshijnë:
- Paralizën ose humbjen e lëvizjes së muskujve. Mund të paralizoheni në njërën anë të trupit ose të humbni kontrollin e muskujve të caktuar, për shembull të njërës anë të fytyrës ose një krah.
- Vështirësinë në të folur ose në gëlltitje. Një goditje në tru mund të ndikojë në funksionimin e muskujve të gojës dhe të fytit, duke e bërë të vështirë për ju të flisni qartë, të gëlltisni ose të hani. Ju gjithashtu mund të keni vështirësi në komunikim, duke përfshirë të folurit ose të kuptuarit e të folurit, leximin ose shkrimin.
- Humbjen e kujtesës ose vështirësi në të menduar. Shumë njerëz që kanë pasur goditje në tru përjetojnë humbje të kujtesës. Të tjerët mund të kenë vështirësi të mendojnë, të arsyetojnë, të bëjnë gjykime dhe të kuptojnë konceptet.
- Problemet emocionale. Njerëzit që kanë pasur goditje në tru mund të kenë më shumë vështirësi të kontrollojnë emocionet e tyre, ose mund të jenë në depresion.
- Dhembjet. Dhembje, mpirje ose ndjesi të tjera të pazakonta mund të shfaqen në pjesët e trupit të prekura nga goditje në tru. Për shembull, nëse humbisni ndjeshmërinë në krahun e majtë, mund të fitoni një ndjesi të pakëndshme shpimi gjilpërash në atë krah.
- Ndryshimet në sjellje dhe aftësinë për vetëkujdes. Njerëzit që kanë pasur goditje në tru mund të bëhen më të tërhequr nga shoqëria. Ata mund të kenë nevojë për ndihmë me punët e përditshme.
Si mund ta parandaloj goditjen në tru?
Njohja e faktorëve të rrezikut për goditje në tru, ndjekja e rekomandimeve të ofruesit të kujdesit shëndetësor dhe një stil jetese e shëndetshme janë hapat më të mirë që mund të ndërmerrni për të parandaluar një goditje në tru. Nëse keni pasur një goditje në tru ose një atak iskemik kalimtar (TIA), këto masa mund të ndihmojnë në parandalimin e një goditjeje tjetër. Gjithashtu ka rëndësi edhe kujdesi pas përfundimit të trajtimit spitalor.
Shumë strategji për parandalimin e goditjes në tru janë të njëjta me strategjitë për të parandaluar sëmundjet e zemrës. Në përgjithësi, rekomandimet për një mënyrë jetese të shëndetshme përfshijnë:
- Kontrolli i shtypjes së lartë të gjakut (hipertensionit)– është një nga faktorët më të rëndësishëm që mund të bëni për të reduktuar rrezikun e goditjes në tru. Nëse keni pasur një goditje në tru, ulja e shtypjessë gjakut mund të ndihmojë në parandalimin e një TIA ose goditje tjetër të trurit. Ndryshimet e jetesës së shëndetshme dhe medikamentet përdoren shpesh për të trajtuar presionin e lartë të gjakut.
- Ulja e sasisë së kolesterolit dhe yndyrave të ngopura në dietën tuaj. Marrja e ushqimeve me më pak kolesterol dhe yndyrë, mund të zvogëlojë grumbullimin e këtyre të fundit në arterie. Nëse nuk mund të kontrolloni nivelet e kolesterolit vetëm përmes ndryshimeve dietike, mjeku juaj mund të përshkruajë një ilaç për uljen e kolesterolit.
- Lënia e përdorimit të duhanit. Pirja e duhanit rrit rrezikun e goditjes në tru për duhanpirësit dhe joduhanpirësit të ekspozuar ndaj tymit të dorës së dytë. Lënia e përdorimit të duhanit zvogëlon rrezikun e goditjes në tru.
- Menaxhimi i diabetit. Dieta, ushtrimet fizike dhe humbja e peshës mund t'ju ndihmojnë të mbani nivele normale të sheqerit në gjak. Nëse faktorët e stilit të jetesës nuk janëtë mjaftueshme për të kontrolluar diabetin tuaj, mjeku juaj mund të përshkruajë ilaçe për sëmundjen e diabetit.
- Ruajtja e një peshe të shëndetshme. Të qenit mbipeshë kontribuon në faktorë të tjerë të rrezikut për goditje në tru, si presioni i lartë i gjakut, sëmundjet kardiovaskulare dhe diabeti.
- Konsumimi i një diete të pasur me fruta dhe perime. Një dietë që përmban pesë ose më shumë racione frutash ose perimesh në ditë mund të zvogëlojë rrezikun e goditjes në tru. Si shembull mund të jetë dieta mesdhetare ku përfshihet vaji i ullirit, frutat, arrat, perimet dhe drithërat.
- Duke ushtruar rregullisht. Ushtrimet aerobike reduktojnë rrezikun e goditjes në tru në shumë mënyra. Mund të ulin presionin e gjakut, të rrisin nivelet e kolesterolit të mirë dhe të përmirësojnë gjendjen e përgjithshme shëndetësore të enëve të gjakut dhe zemrës. Gjithashtu ju ndihmon të humbni peshë, të kontrolloni diabetin dhe të reduktoni stresin. Gradualisht ushtroni deri në 30 minuta aktivitet fizik mesatar - të tillë si ecja, vrapimi, noti ose biçikleta - të paktën në shumicën e ditëvetë javës.
- Pirja e alkoolit. Konsumimi i madh i alkoolit rrit rrezikun e presionit të lartë të gjakut, goditjeve iskemike dhe goditjeve hemorragjike. Alkooli gjithashtu mund të ndërveprojë me medikamente të tjera që jeni duke marr. Flisni me mjekun tuaj për atë që është më e përshtatshme për ju.
- Trajtimi i apneas obstruktive të gjumit (OSA). Mjeku juaj mund të rekomandojë një studim gjumi nëse keni simptoma të OSA - një çrregullim gjumi që ju bën të ndaloni frymëmarrjen për periudha të shkurtra në mënyrë të përsëritur gjatë gjumit. Trajtimi për OSA përfshin një pajisje që jep presion pozitiv në rrugët e frymëmarrjes përmes një maske për të mbajtur rrugët e frymëmarrjes të hapura ndërsa flini.
- Shmangia e drogave ilegale. Disa drogasi kokaina dhe metamfetamina, janë faktorë rreziku të njohur për një TIA ose një goditje në tru.
Medikamentet parandaluese
Nëse keni pasur një goditje iskemike në tru ose një TIA, mjeku juaj mund të rekomandojë medikamente që ndihmojnë në uljen e rrezikut për të pasur një goditje tjetër. Këtu perfshihen:
- Medikamentet antigreguese. Trombocitet janë qeliza në gjak që formojnë mpiksje të gjakut. Medikamentet antiagreguese zvogëlojnë mundësinë e formimit të mpiksjeve të gjakut (trombeve). Medikamenti më i njohur nga ky lloj është aspirina. Mjeku juaj mund t'ju ndihmojë në përcaktimin e dozën se duhur të aspirinës për ju.
- Pas një TIA ose goditjeje të vogël të trurit, mjeku juaj mund t'ju përshkruajë aspirinë dhe një ilaç tjetër antiagregues si klopidogrel për një periudhë kohore për të zvogëluar rrezikun e një goditjeje tjetër. Nëse nuk mund të merrni aspirinë, mjeku juaj mund të përshkruajë vetëm klopidogrel.
- Antikoagulantët. Këto barna reduktojnëkoagulimin e gjakut. Heparina vepron shpejt dhe mund të përdoret për një kohë të shkurtër në spital.
- Varfarina me veprim të ngadaltë mund të përdoret për një afat më të gjatë. Varfarina është një ilaç i fuqishëm për hollimin e gjakut, kështu që do t'ju duhet ta merrni atë saktësisht sipas udhëzimeve dhe të raportoni për efekte anësore. Juve gjithashtu do të ju duhet të bëni rregullisht teste të gjakut për të monitoruar efektet e Varfarinës.
Disa medikamente më të reja për hollimin e gjakut (antikoagulantë) janë në dispozicion për parandalimin e goditjeve në tru tek njerëzit që kanë një rrezik të lartë. Këto medikamente përfshijnë dabigatran (Pradaxa), rivaroksaban (Xarelto), apiksaban (Eliquis) dhe edoksaban (Savaysa). Ato kanë një veprim më të shkurtër se varfarina dhe zakonisht nuk kërkojnë analiza të rregullta gjaku ose monitorim nga mjeku juaj. Këto barna shoqërohen gjithashtu me një rrezik më të ulët të komplikimeve të gjakderdhjes në krahasim me varfarinën.
Ekzaminimet
- Ekzaminimi fizik – Me anë të ekzaminimit neurologjik do të vlerësohet se sa një goditje e mundshme e trurit ka prekur sistemin nervor.
- Analizat e gjakut – Këtu përfshihen si shembull testet e koagulimit të gjakut, testi i glikemisë, analizat infektive.
- Tomografia e kompjuterizuar e kokës – TK-ja përdor rrezet X për të krijuar një pamje të detajizuar të trurit. Një TK e kokës mund të vlerësojë gjakderdhjen në tru, goditjen iskemike, tumoret dhe të tjera patologji. Me anë të injektimit të kontrastit mund tëvizualizohen enët e gjakut në qafë dhe tru në detaje (TK-angjiografi).
- Imazheria me rezonancë magnetike – Me anë të radio-valëve të fuqishme dhe një fushe magnetike për të krijuar një pamje të detajuar të trurit. Me anë tëMRI-së mund të zbulohet indi i trurit që është dëmtuar nga një goditje iskemike apo gjakderdhje në tru. Nëse është e nevojshme mjeku juaj mund të kërkojë një ekzaminim me kontrast (angjiografi me rezonancë magnetike ose venografi me rezonancë magnetike).
- Ekografi karotide – Me anë të valëve të zërit krijohen imazhe të detajuara të arterieve karotide në qafë. Në këtë mënyrë mund të shihet grumbullimi i depozitave yndyrore (pllakat) dhe rrjedhjen e gjakut në arteriet karotide.
- Angjiogrami cerebral– Me anë të këtij testi që përdoret rrallë, futet një tub i hollë, fleksibël (kateter) përmes një prerjeje të vogël, zakonisht në ijë, deri te arteriet kryesore dhe në arterien karotide ose vertebrale. Pastaj mjeku juaj injekton kontrastin në enët e gjakut për t'i bërë ato të dukshme nën imazhet me rreze X. Kjo procedurë jep një pamje të detajuar të arterieve në tru dhe qafë.
- Ekokardiogrami– Një ekokardiogram përdor valët e zërit për të krijuar imazhe të detajuara të zemrës. Një ekokardiogram mund të gjejë një burim mpiksjesh gjaku (tromb)në zemër që mund të ketë udhëtuar nga zemra në tru dhe të ketë shkaktuar një goditje në tru.
TK e kokës pa kontrast:
Mjekimi
Për të trajtuar një goditje iskemike, mjekët duhet të rivendosin shpejt rrjedhën e gjakut në tru. Kjo mund të bëhet me:
- Terapia emergjente intravenoze– Terapia e cila mund ta bëjë shkrirjen e trombit duhet të jepet brenda 4.5 orëve nga fillimi i simptomave nëse jepet në mënyrë intravenoze. Sa më shpejt, aq më mirë. Trajtimi i shpejtë jo vetëm që përmirëson shanset tuaja për të mbijetuar, por gjithashtu mund t’i zvogëlojë komplikimet.
Një injeksion intravenoz i aktivizuesit rekombinant të plazminogjenit të indeve (rTPA) – i quajtur alteplase (Activase) ose tenecteplase (TNKase) – është trajtimi standard i artë për goditjen iskemike. Terapia jepet përmes një vene në krah brenda tre orëve të para. Ndonjëherë, mund të jepet deri në 4.5 orë pas fillimit të simptomave të goditjes në tru.
Ky medikament rikthen rrjedhjen e gjakut duke e shpërbërë trombin që shkakton goditjen në tru. Në këtë mënyrë duke e trajtuar shpejt shkakun e goditjes në tru, mund tëndikojë edhe në procesin e shërimit. Mjeku juaj do të marrë parasysh disa rreziqe, të tilla si gjakderdhja e mundshme në tru, për të përcaktuar nëse TPA është e përshtatshme për ju.
- Procedurat endovaskulare emergjente –Goditja iskemike trajtohet ndonjëherë direkt brenda enës së bllokuar të gjakut. Terapia endovaskulare përmirëson dukshëm rezultatet dhe redukton paaftësinë afatgjatë pas goditjes iskemike. Këto procedura duhet të kryhen sa më shpejt që të jetë e mundur:
- Medikamentet që shpërndahen direkt në tru– Mjekët futin një tub të gjatë e të hollë (kateter) përmes një arterie në ijë dhe e kalojnë atë në tru për të dhënë TPA direkt aty ku po ndodh goditja. Afati kohor për këtë trajtim është disi më i gjatë se për TPA të injektuar, por është ende i kufizuar.
- Heqja e trombit me një stentretriever–Mjekët mund të përdorin një pajisje të lidhur me një kateter për të hequr drejtpërdrejt mpiksjen nga ena e bllokuar e gjakut në tru. Kjo procedurë është veçanërisht e dobishme për njerëzit me mpiksje të mëdha të gjakut që nuk mund të shpërbëhen plotësisht me TPA. Kjo procedurë shpesh kryhet në kombinim me TPA të injektuar.
Dritarja kohore kur mund të konsiderohen këto procedura është zgjatur për shkak të teknologjisë më të re imazherike. Mjekët mund të kërkojnë teste imazherike të perfuzionit (të kryera me TK ose MRI) për të ndihmuar në përcaktimin se sa gjasa ka që dikush të përfitojë nga terapia endovaskulare.
Procedura të tjera
Për të ulur rrezikun e mundësisë së përsëritjes të njënjë goditje tjetër të trurit ose atakut iskemik kalimtar, mjeku juaj mund të rekomandojë një procedurë për hapjen e një arterie që është ngushtuar nga pllaka yndyrore. Opsionet ndryshojnë në varësi të situatës, por këtu përfshihet:
- Endarterektomia karotide –Meanë të këtij intervenimilargohet pllaka trombotike që e bllokon një arterie karotide (arteriet karotide janë enët e gjakut që kalojnë përgjatë secilës anë të qafës, duke furnizuar trurin me gjak)duke zvogëluar në këtë mënyrë rrezikun e goditjes iskemike. Një endarterektomi karotide ka edhe rreziqe, veçanërisht për njerëzit me sëmundje të zemrës ose probleme të tjera shëndetësore.
- Angjioplastika dhe stentet - Në një angjioplastikë, një kirurg fut një kateter në arteriet karotide përmes një arterie në ijë. Më pas fryhet një balon për të zgjeruar arterien e ngushtuar. Përfundimisht mund të vendoset një stent për të mbështetur arterien e hapur.
Rikuperimi dhe rehabilitimi pas goditjes në tru
Pas trajtimit emergjent, do të monitoroheni nga afër për të paktën një ditë. Pas kësaj, kujdesi për goditjen në tru fokusohet në ndihmën që ju të rikuperoni sa më shumë funksione (aftësi) që të jetë e mundur dhe t'i ktheheni jetës së pavarur. Ndikimi i goditjes varet nga zona e trurit të përfshirë dhe sasia e indeve të dëmtuara.
Nëse goditja e trurit ka prekur anën e djathtë të trurit, mund të preken lëvizja dhe ndjeshmëria në anën e majtë të trupit. Nëse goditja në tru ka dëmtuar indin e trurit në anën e majtë të trurit, mund të preken lëvizja dhe ndjeshmëria juaj në anën e djathtë të trupit. Dëmtimi i trurit në anën e majtë mund të shkaktojë çrregullime të të folurit.
Shumica e të mbijetuarve nga goditjet në tru udhëzohen për të qenë pjesë e një programi për rehabilitim. Mjeku juaj do t'ju rekomandojë programin e terapisë që ju mund të përballoni duke u bazuar në moshën tuaj, shëndetin e përgjithshëm dhe shkallën e paaftësisë nga goditja në tru. Gjithashtu do tëmirren parasysh mënyra juaj e jetesës, interesat dhe prioritetet, si dhe sa janëtë gatshëm/në dispozicion anëtarëte familjes ose kujdestarëte tjerë.
Rehabilitimi mund të fillojë përpara se të dilni nga spitali. Pas lëshimit nga spitali, ju mund të vazhdoni programin tuaj në një njësi rehabilitimi të të njëjtit spital, një njësi tjetër rehabilitimi, një institucion infermieror të kualifikuar ose në shtëpi.
Rikuperimi i infarktit në tru te çdo person është i ndryshëm
Në varësi të gjendjes suaj shëndetësore, ekipi juaj i trajtimit mund të përbëhet nga:
- Mjeku i trajnuar për sëmundjet e trurit (neurolog)
- Mjeku për rehabilitim (fiziatër)
- Infermierja e rehabilitimit
- Dietologu
- Fizioterapeuti
- Terapisti profesionist/i punës
- Terapisti rekreativ
- Patologu i të folurit
- Punonjësi social ose menaxhues rasti
- Psikologu ose psikiatër
- Përfaqësuesi fetar
Një goditje në tru ndryshon jetën tuaj e që mund të ndikojë në mirëqenien tuaj emocionale po aq sa aftësitë tuaja fizike. Ndonjëherë mund të ndjeheni të pafuqishëm, të frustruar, të dëshpëruar dhe apatikë.
Ruajtja e vetëvlerësimit tuaj, lidhjes me të tjerët dhe interesimit për botën janë pjesë thelbësore të procesit të shërimit. Disa strategji që mund t'ju ndihmojnë juve dhe atyre që kujdesen për ju janë:
- Mos jini të ashpër me veten – Pranojeni faktin se rikuperimi fizik dhe emocional është një proces i vështirë dhe se do të marrë kohë. Synoni për një "normale të re" dhe jini të kënaqur me çdo përmirësim tuajin. Ndani kohën për tëpushuar.
- Bashkohuni me një grup mbështetës - Takimi me të tjerët që kanë pasur një goditje në tru ju lejon të ndani përvoja, të shkëmbeni informacione dhe të krijoni miqësi të reja.
- Ndani me miqtë dhe familjarët nevojat që keni –Të tjerët mund të duan t’ju ndihmojnë, por ata mund të mos dinë se si ta bëjnë këtë. Tregojuni atyre se si mund të ndihmojnë, si për shembull duke u sjellë ushqim, duke biseduar me ju, ose duke marrë pjesë në ngjarje sociale ose aktivitete fetare me ju.
Sfidat e komunikimit
Vështirësitënë të folur mund të jenë veçanërisht frustruese. Më poshtë mund të gjeni këshilla për t'ju ndihmuar juve dhe atyre që kujdesen për juve që të përballeni me sfidat e komunikimit:
- Ushtroni – Mundohunitë bëni një bisedë të paktën një herë në ditë. Do t'ju ndihmojë të ndiheni të afërt me të tjerët dhe të rindërtoni vetëbesimin tuaj.
- Relaksohuni dhe kini durim – Të folurit mund të jetë më i lehtë dhe më i këndshëm në një situatë relaksuese kur nuk jeni duke nxituar.
- Shprehuni sipas mënyrës suaj – Kur jeni duke u përmirësuarpas një goditjeje në tru, mund t'ju duhet të përdorni gjeste ose tonin e zërit për të komunikuar.
- Përdorni mjete ndihmëse komunikuese – Mund t'ju ndihmojë përdorimi i kartave që tregojnë fjalë që përdoren shpesh ose fotografi të shoqërisë së ngushtë apo familjarëve.
REFERENCAT:
1. MayoClinic https://www.mayoclinic.org/diseases-conditions
2. NHS https://www.nhs.uk/conditions/
3. Medscape https://emedicine.medscape.com/
Përgatiti: Dr. Edita Malazogu
Redaktoi: Ass. Dr. Blerim Myftiu
Gusht 2024
EPILEPSITË
PËRKUFIZIMI
Sipas Ligës Ndërkombëtare Kundër Epilepsisë (ILAE), një person konsiderohet se ka epilepsi nëse plotëson ndonjë nga kriteret e mëposhtme:
- Të paktën dy kriza epileptike të paprovokuara (ose reflekse) që ndodhin me më shumë se 24 orë distancë kohore.
- Një krizë epileptike e paprovokuar (ose refleks) dhe një probabilitet për kriza të mëtejshme të ngjashme me rrezikun e përsëritjes së përgjithshme (të paktën 60%) pas dy krizave të paprovokuara, që ndodhin gjatë 10 viteve të ardhshme.
- Diagnoza e sindromës së epilepsisë
Epilepsia konsiderohet e kaluar për individët që kanë pasur një sindromë të epilepsisë së varur nga mosha, por tani kanë kaluar moshën e zbatueshme ose ata që kanë qenë pa kriza epileptike për dhjetë vitet e fundit dhe pa terapi antiepileptike në pesë vitet e fundit.
Krizat epileptike janë manifestim i shkarkimeve jonormale hipersinkrone ose hipereksitatore të neuroneve kortikale. Shenjat klinike ose simptomat e krizave varen nga lokalizimi i shkarkimeve elektrike në korteksin cerebral dhe nga shtrirja dhe modeli i përhapjes së shkarkimit elektrik në tru. Andaj simptomat e krizave epileptike janë shumë të ndryshme, por për shumicën e pacientëve me një fokus, simptomat janë zakonisht shumë stereotipike.
Zakonisht krizat epileptike janë një manifestim jospecifik i çrregullimeve dhe sëmundjeve neurologjike, sepse funksioni kryesor i trurit është transmetimi i impulseve elektrike. Mundësia gjatë gjithë jetës për të përjetuar të paktën një krizë epileptike është rreth 9%, dhe gjasat që gjatë gjithë jetës për të marrë një diagnozë të epilepsisë është pothuajse 3%. Megjithatë, prevalenca e epilepsisë aktive është vetëm rreth 0.8%.
ETIOLOGJIA
Epilepsia nuk ka ndonjë shkak të identifikueshëm në rreth gjysmën e njerëzve të diagnostikuar me këtë sëmundje. Në gjysmën tjetër, sëmundje mund të shkaktohet nga faktorë të ndryshëm, duke përfshirë:
- Faktorët gjenetikë. Me revolucionin në teknikat e testimit gjenetik, janë identifikuar shumë gjene që kontribuojnë në etiologjinë e epilepsisë. Variantet gjenetike që kontribuojnë në etiologjinë e epilepsisë mund të jenë të zakonshme ose të rralla, të përcaktuara nga fakti nëse ato janë të pranishme në ≥1% ose <1% të popullsisë.
- Faktorët strukturorë. Lezionet strukturore që më së shpeshti shkaktojnë epilepsi mund të ndahen në gjashtë kategori kryesore të sëmundjeve: skleroza hipokampale, tumoret e trurit, keqformimet e zhvillimit kortikal, keqformimet vaskulare, lezionet gliale (duke përfshirë insultin iskemik trunor dhe dëmtimin traumatik të trurit) dhe inflamacioni i trurit.
- Faktorët infektivë. Infeksionet e rënda sistemike, edhe nëse nuk prekin drejtpërdrejt trurin, mund të predispozojnë për kriza epileptike përmes pireksisë, lirimit të citokineve, disfunksionit metabolik dhe nxitjes së autoimunitetit. Meningjiti, HIV AIDS, encefaliti viral dhe disa infeksione parazitare mund të shkaktojnë kriza epileptike.
- Faktorët metabolikë. Shkaqet metabolike të epilepsisë mund të jenë ose të fituara ose të lindura. Shkaqet e fituara metabolike janë pamjaftueshmëria e një organi (p.sh. mëlçisë, veshkave ose pankreasit), deficitet nutritive, shkaqeve autoimune (p.sh. diabeti melit i tipit I, mungesës cerebrale autoimune të folatit) ose barnave dhe toksinave ekzogjene. Ekzistojnë rreth 200 çrregullime metabolike të lindura që mund të shkaktojnë kriza epileptike.
- Faktorët imunologjikë. Krizat epileptike janë njohur prej kohësh të jenë të lidhura me disa sëmundje autoimune, të tilla si lupusi eritrematoz sistemik, sarkoidoza, sëmundja e celiakisë, sëmundja Behçet dhe encefalopatia Hashimoto.
- Lëndimet prenatale. Para se të lindin, foshnjat janë të ndjeshme ndaj dëmtimit të trurit që mund të shkaktohet nga disa faktorë. Ato mund të përfshijnë një infeksion të nënës, ushqim të dobët ose mungesë oksigjeni. Ky dëmtim i trurit mund të rezultojë në epilepsi ose paralizë cerebrale.
- Çrregullimet zhvillimore. Epilepsia ndonjëherë mund të ndodhë me çrregullime zhvillimore. Njerëzit me autizëm kanë më shumë gjasa të kenë epilepsi sesa njerëzit pa autizëm. Hulumtimet kanë zbuluar gjithashtu se njerëzit me epilepsi kanë më shumë gjasa të kenë çrregullime të tjera zhvillimore, si çrregullimi i mungesës së vëmendjes/hiperaktivitetit (ADHD). Pasja e të dyja gjendjeve mund të lidhet me gjenet e përfshira si në epilepsi ashtu edhe në çrregullime zhvillimore.
PATOGJENEZA
Një krizë epileptike ndodh kur ka një çrregullim të ekuilibrit normal ndërmjet sinjaleve eksitatore (E) dhe inhibitore (I) të trurit. Ky çekuilibër E/I mund të rezultojë nga ndryshimet në shumë nivele të funksionit të trurit, nga gjenet, nga kaskadat e sinjalizimi nënqelizor dhe nga qarqet neuronale të përhapura. Faktorët që ndryshojnë ekuilibrin E/I mund të jenë gjenetik ose të fituar. Patologjitë gjenetike që çojnë në epilepsi mund të ndodhin kudo nga niveli i qarkut (p.sh., lidhje jonormale sinaptike në displazionin kortikal), në nivelin e receptorëve (p.sh., nën-njësi receptore jonormale të acidit g-aminobutirik (GABA) në sindromën Angelman), deri në funksionin jonormal të kanalit jonik (p.sh., mutacionet e kanalit të kaliumit në epilepsinë beninje familjare neonatale (BFNE)). Në mënyrë të ngjashme, insultet cerebrale të fituara mund të ndryshojnë funksionin e qarkut (p.sh., ndryshimi strukturor i qarkut hipokampal pas konvulsioneve febrile të zgjatura ose traumave të kokës).
Truri gjatë zhvillimit është veçanërisht i prirë ndaj krizave epileptike për një sërë arsyesh fiziologjike. Gjatë zhvillimit normal të trurit, funksioni sinaptik eksitator zhvillohet më herët se funksioni sinaptik inhibitor, duke favorizuar ngacmimin e theksuar dhe gjenerimin e krizave epileptike. Përveç kësaj, në fillim të jetës, neurotransmetuesi GABA shkakton ngacmim dhe jo inhibim. Kjo shpjegon pjesërisht pse truri gjatë zhvillimit është veçanërisht të ndjeshëm ndaj krizave epileptike. Megjithatë, krizat epileptike shkaktojnë më pak dëme strukturore në trurin në zhvillim sesa në trurin e të rriturve.
PARAQITJA KLINIKE (SIMPTOMAT DHE SHENJAT)
Simptomat e epilepsisë ndryshojnë në varësi të llojit të epilepsisë. Për shkak se epilepsia shkaktohet nga një aktivitet i caktuar në tru, krizat mund të ndikojnë në çdo proces të trurit. Simptomat e krizave epileptike mund të përfshijnë:
- Konfuzion i përkohshëm
- Shikim i fiksuar
- Shtangim i muskujve
- Lëvizje e pakontrolluar e krahëve dhe këmbëve
- Errësim vetëdijes
- Simptoma psikologjike si frikë, ankth ose déjà vu
- Kafshim gjuhe
- Urinim i pakontrolluar
Shenjat paralajmëruese të krizave epileptike (Aura)
Disa njerëz me epilepsi fokale përjetojnë shenja paralajmëruese në momentet para fillimit të një krize epileptike. Këto shenja paralajmëruese njihen si aura. Ato mund të përfshijnë një ndjesi (parehati) në lukth apo një emocion të tillë si frika dhe deja vu. Aurat gjithashtu mund të jenë si një ndjesi e një shije ose një ere. Aura mund të jetë edhe vizuale, si një dritë e qëndrueshme ose ndezëse, një ngjyrë ose një formë. Disa njerëz mund të përjetojnë marramendje dhe humbje të ekuilibrit. Të tjerët mund të përjetojnë halucinacione vizuale.
KLASIFIKIMI
Epilepsitë klasifikohen si epilepsi fokale, të gjeneralizuara dhe të kombinuara fokale dhe të gjeneralizuara, bazuar në atë se si dhe ku fillon aktiviteti i trurit që shkakton krizat epileptike.
Epilepsitë fokale
Kur krizat epileptike vijnë nga aktiviteti në vetëm një zonë të trurit, ajo quhet epilepsi fokale. Këto epilepsi ndahen në dy kategori:
- Epilepsi fokale pa vetëdije të ndryshuar. Pasi quhen kriza të thjeshta të pjesshme, këto kriza nuk shkaktojnë humbje të vetëdijes. Ato mund të ndryshojnë emocionet ose të ndryshojnë mënyrën se si gjërat duken, nuhasin, ndjejnë, shijojnë ose tingëllojnë. Disa njerëz përjetojnë deja vu. Kjo lloj krize gjithashtu mund të rezultojë në dridhje të pavullnetshme të një pjese të trupit, si një krah ose këmbë, dhe simptoma spontane sensitive si ndjesi shpimi gjilpërash, marramendje dhe ndezje të dritave.
- Epilepsi fokale me vetëdije të ndryshuar. Dikur quhej epilepsi komplekse e pjesshme dhe këto kriza epileptike përfshijnë një ndryshim ose humbje të vetëdijes. Gjatë një krize epileptike fokale me vetëdije të ndryshuar, njerëzit mund të shikojnë në hapësirë dhe të mos i përgjigjen në mënyrë atipike mjedisit. Ata gjithashtu mund të kryejnë lëvizje të përsëritura, të tilla si fërkimi i duarve, përtypja, gëlltitja ose ecja në rrathë.
Llojet e epilepsive fokale sipas lokalizimit janë:
- Epilepsitë e lobit frontal. Epilepsitë e lobit frontal fillojnë nga pjesa e përparme të trurit. Kjo është pjesa e trurit që kontrollon lëvizjen. Krizat epileptike të lobit frontal bëjnë që njerëzit të lëvizin kokën dhe sytë në njërën anë. Ata nuk do të përgjigjen kur u flitet dhe mund të bërtasin ose të qeshin. Ata mund të zgjasin njërën krah dhe të përkulin krahun tjetër. Ata gjithashtu mund të bëjnë lëvizje të përsëritura si lëkundjet ose pedalimet me biçikletë.
- Epilepsitë e lobit temporal. Epilepsitë e lobit të temporal fillojnë nga zonat e trurit të quajtura lobet temporale. Lobet temporale përpunojnë emocionet dhe luajnë një rol në kujtesën afatshkurtër. Njerëzit që kanë këto kriza shpesh përjetojnë një aurë. Aura mund të përfshijë emocione të papritura si frika ose gëzimi, një shije ose erë e papritur, një ndjenjë e deja vu-së ose një ndjesi ngritjeje në stomak. Gjatë krizës epileptike njerëzit mund të humbasin vetëdijen për rrethin e tyre, të shikojnë në hapësirë, të godasin buzët, të gëlltisin ose të përtypin në mënyrë të përsëritur, ose të kenë lëvizje të pazakonta të gishtërinjve.
- Epilepsitë e lobit okcipital. Këto epilepsi fillojnë nga zona e trurit e quajtur lobi okcipital. Ky lob është përgjegjës për shikimin dhe mënyrën se si njerëzit shohin. Njerëzit që kanë këtë lloj epilepsisë mund të kenë halucinacione vizuale. Po ashtu ata mund të humbasin një pjesë ose të gjithë shikimin e tyre gjatë një krize. Këto krizat gjithashtu mund të shkaktojnë vezullim të syve ose t'i bëjnë sytë të lëvizin.
Epilepsitë e gjeneralizuara
Epilepsitë që duket se përfshijnë të gjitha zonat e trurit quhen epilepsi të përgjithësuara. Epilepsitë e përgjithësuara përfshijnë:
- Epilepsitë absance. Krizat e tilla, të njohura më parë si epilepsia petit mal, zakonisht ndodhin tek fëmijët. Simptomat përfshijnë shikimin në hapësirë me ose pa lëvizje të trupit. Lëvizjet mund të përfshijnë pulsimin e syve ose goditjen e buzëve dhe zgjasin vetëm 5 deri në 10 sekonda. Këto kriza mund të ndodhin në grupe, që ndodhin deri në 100 herë në ditë dhe shkaktojnë një humbje të shkurtër të vetëdijes.
- Epilepsitë tonike. Krizat tonike shkaktojnë shtangim të muskujve dhe mund të ndikojnë në vetëdijen. Këto kriza zakonisht prekin muskujt e shpinës, krahët dhe këmbët dhe mund të shkaktojnë rrëzime në tokë.
- Epilepsitë atonike. Krizat atonike, të njohura gjithashtu si krizat me rrëzim, shkaktojnë humbje të kontrollit të muskujve. Meqenëse kjo më së shpeshti prek këmbët, shpesh shkakton kolaps të papritur ose rrëzime në tokë.
- Epilepsitë klonike. Krizat epileptike klonike shoqërohen me lëvizje të përsëritura ose ritmike të dridhjeve të muskujve. Këto kriza zakonisht prekin qafën, fytyrën dhe krahët.
- Epilepsitë mioklonike. Krizat mioklonike zakonisht shfaqen si dridhje të shkurtra të papritura dhe zakonisht prekin pjesën e sipërme të trupit, krahët dhe këmbët.
- Epilepsitë toniko-klonike. Krizat epileptike toniko-klonike, të njohura më parë si epilepsitë grand mal, janë lloji më dramatik i krizave epileptike. Ato mund të shkaktojnë një humbje të papritur të vetëdijes dhe shtangime dhe dridhje të trupit. Po ashtu, këto kriza epileptike ndonjëherë shkaktojnë humbje të kontrollit të fshikëzës urinare ose kafshim të gjuhës.
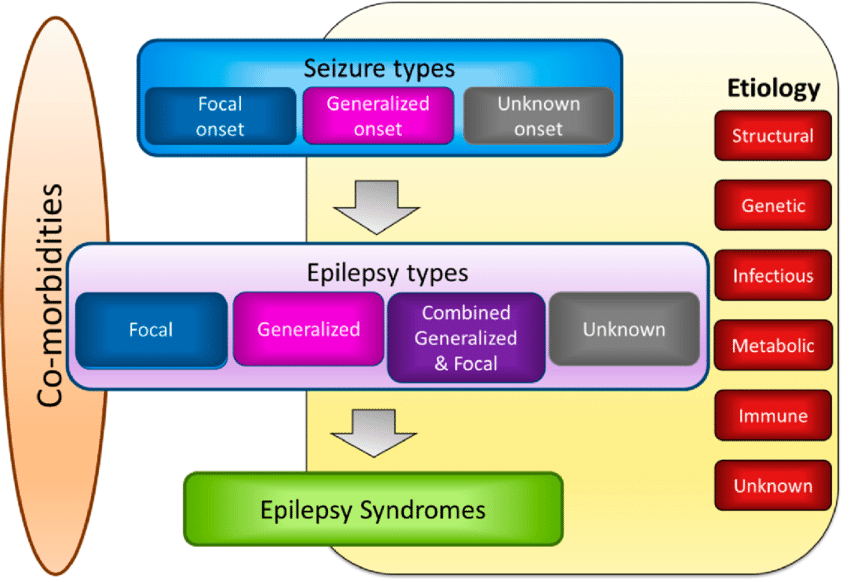
Kur të konsultohet një mjek?
Kërkoni ndihmë të menjëhershme mjekësore nëse ndodh ndonjë nga sa vijon:
- Kriza epileptike zgjat më shumë se pesë minuta.
- Frymëmarrja ose vetëdija nuk kthehen pas ndalimit të krizave epileptike.
- Një krizë epileptike e dytë pason menjëherë.
- Keni temperaturë të lartë.
- Ju jeni shtatzënë.
- Ju keni diabet.
- Ju keni lënduar veten gjatë krizës epileptike.
- Ju vazhdoni të keni kriza epileptike edhe pse keni marrë medikamentet adekuate.
- Nëse përjetoni një krizë epileptike për herë të parë, kërkoni këshilla mjekësore.
FAKTORET E RREZIKUT
Disa faktorë mund të rrisin rrezikun e epilepsisë:
- Mosha. Shfaqja e epilepsisë është më e zakonshme tek fëmijët dhe të moshuarit, por epilepsia mund të shfaqet në çdo moshë.
- Historia familjare. Nëse keni një histori familjare të epilepsisë, mund të jeni në një rrezik të shtuar për të pësuar kriza epileptike.
- Lëndimet në kokë. Lëndimet e kokës janë përgjegjëse për disa raste të epilepsisë. Ju mund të zvogëloni rrezikun tuaj duke vendosur rripin e sigurimit gjatë vozitjes në një makinë dhe duke vendosur një helmetë kur jeni duke ecur me biçikletë, ski, ngisni një motoçikletë ose duke u angazhuar në aktivitete të tjera me rrezik të lartë të dëmtimit të kokës.
- Insulti iskemik trunor dhe sëmundje të tjera vaskulare. Insulti iskemik trunor dhe sëmundjet tjera vaskulare mund të shkaktojnë dëmtim të trurit. Dëmtimi i trurit mund të shkaktojë kriza epileptike dhe epilepsi. Mund të ndërmerrni një sërë hapash për të reduktuar rrezikun e këtyre sëmundjeve një diete të shëndetshme dhe aktivitetit fizik e rregullt.
- Demenca. Demenca mund të rrisë rrezikun e epilepsisë tek të moshuarit.
- Sëmundjet infektive të trurit. Infeksione të tilla si meningjitet dhe encefalitet, të cilat shkaktojnë inflamacion në meningje, në tru ose në palcën kurrizore, mund të rrisë rrezikun për kriza epileptike.
- Konvulsionet febrile në fëmijëri. Temperatura e lartë trupore në fëmijëri ndonjëherë mund të shoqërohet me kriza epileptike. Fëmijët që kanë kriza për shkak të temperaturës së lartë në përgjithësi nuk do të zhvillojnë epilepsi. Rreziku i epilepsisë rritet nëse një fëmijë ka një krizë të gjatë të lidhur me temperaturën, një sëmundje tjetër të sistemit nervor ose një histori familjare të epilepsisë.
KOMPLIKIMET
Të kesh një krizë të vetëdijes në momente të caktuara mund të çojë në rrethana që janë të rrezikshme për veten ose të tjerët.
- Lëndimet nga rrëzimi. Rrëzimi gjatë një krize epileptike mund të shkaktojë lëndime të kokës dhe fraktura të kockave.
- Mbytja në ujë. Nëse keni epilepsi, keni 13 deri në 19 herë më shumë gjasa të mbyteni gjatë notit ose larjes sesa pjesa tjetër e popullsisë për shkak të mundësisë për të pasur një krizë gjatë kohës që jeni në ujë.
- Aksidentet automobilistike. Një krizë epileptike që shkakton humbje të vetëdijes ose kontrollit mund të jetë e rrezikshme nëse jeni duke drejtuar një makinë. Shumë shtete kanë kufizime për patentën e shoferit që lidhen me aftësinë e shoferit për të kontrolluar krizat epileptike. Në këto shtete, ekziston një kohë minimale që një shofer duhet të jetë pa kriza, duke filluar nga muaj në vite, përpara se të lejohet të drejtojë makinën.
- Problemet me gjumin. Njerëzit që kanë epilepsi gjithashtu priren të kenë probleme me gjumin, të tilla si probleme për të fjetur ose për të qëndruar në gjumë, të njohura si pagjumësi.
- Komplikimet e shtatzënisë. Krizat gjatë shtatzënisë paraqesin rrezik si për nënën ashtu edhe për foshnjën, dhe disa medikamente antiepileptike rrisin rrezikun e defekteve të lindjes. Nëse keni epilepsi dhe po mendoni të mbeteni shtatzënë, merrni ndihmë mjekësore ndërsa planifikoni shtatzëninë tuaj. Shumica e grave me epilepsi mund të mbeten shtatzënë dhe të kenë fëmijë të shëndetshëm. Ju do të duhet të monitoroheni me kujdes gjatë gjithë shtatzënisë dhe terapia juaj mund të modifikohet. Është shumë e rëndësishme që të punoni me ekipin tuaj të kujdesit shëndetësor për të planifikuar shtatzëninë tuaj.
- Problemet me memorien. Njerëzit me disa lloje të epilepsisë kanë probleme me kujtesën.
- Problemet e shëndetit emocional. Njerëzit me epilepsi kanë më shumë gjasa të kenë probleme psikologjike. Problemet mund të jenë rezultat i trajtimit të vetë gjendjes si dhe efekteve anësore të medikamenteve. Por edhe njerëzit me epilepsi të kontrolluar mirë janë në rrezik të shtuar. Problemet e shëndetit emocional që mund të prekin njerëzit me epilepsi përfshijnë: depresioni, ankthi dhe mendimet dhe sjelljet suicidale.
Komplikime të tjera kërcënuese për jetën e epilepsisë janë të rralla, por mund të ndodhin. Këto përfshijnë:
- Statusi epileptik. Kjo gjendje ndodh nëse ka një aktiviteti të vazhdueshëm epileptik që zgjat më shumë se pesë minuta ose nëse keni kriza të shpeshta të përsëritura pa rifituar vetëdijen e plotë ndërmjet tyre. Njerëzit me status epileptik kanë një rrezik në rritje të dëmtimit të përhershëm të trurit dhe vdekjes.
- Vdekje e papritur në epilepsi (SUDEP). Pacientët me epilepsi gjithashtu kanë një rrezik të vogël të vdekjes së papritur të papritur. Shkaku është i panjohur, por disa studime tregojnë se mund të ndodhë për shkak të sëmundjeve të zemrës ose të frymëmarrjes. Njerëzit me krizat të shpeshta toniko-klonike ose personat, krizat e të cilëve nuk kontrollohen nga medikamentet mund të jenë në rrezik më të lartë të SUDEP. Në përgjithësi, rreth 1% e njerëzve me epilepsi vdesin nga SUDEP. Është më e zakonshme tek ata me epilepsi të rëndë që nuk i përgjigjet trajtimit.
DIAGNOZA
Për të diagnostikuar epilepsitë, profesionisti shëndetësor duhet të rishikojë simptomat dhe historinë mjekësore të pacientit. Ata duhet të i nënshtroheni disa testimeve për të diagnostikuar epilepsinë dhe për të zbuluar shkakun e krizave epileptike. Vlerësimi mund të përfshijë:
- Ekzaminim neurologjik. Ky ekzaminim teston sjelljen tuaj, aftësitë motorike dhe sensitive, funksionet e larta kortikale dhe fusha të tjera për të diagnostikuar dhe për të përcaktuar llojin e epilepsisë që mund të keni.
- Analizat e gjakut. Një mostër gjaku mund të zbulojë shenja të infeksioneve, shkaktarë gjenetike ose shkaktarë të tjera që mund të ndikojnë në shfaqjen me kriza.
- Testimi gjenetik. Në disa njerëz me epilepsi, testimi gjenetik mund të japë më shumë informacion në lidhje me gjendjen dhe mënyrën e trajtimit të tij. Testimi gjenetik kryhet më shpesh tek fëmijët, por mund të jetë i dobishëm edhe në disa të rritur me epilepsi. Po ashtu mund të realizohen një ose më shumë teste dhe skanime të imazhit të trurit që zbulojnë ndryshimet e trurit:
- Elektroencefalogrami (EEG). Ky është testi më i zakonshëm që përdoret për të diagnostikuar epilepsinë. Në këtë test, elektrodat vendosen në lëkurën e kokës dhe regjistrojnë aktivitetin elektrik të trurit tuaj. Testi mund të bëhet në zyrën e një ofruesi të kujdesit shëndetësor ose në spital. Nëse është e përshtatshme, ju gjithashtu mund të keni një EEG ambulatore, të cilën e mbani në shtëpi ndërsa EEG regjistron aktivitetin e krizave gjatë disa ditëve. Nëse keni epilepsi, është e zakonshme të keni ndryshime në modelin tuaj tipik të valëve të trurit. Këto ndryshime ndodhin edhe kur nuk keni një krizë. Ofruesi juaj i kujdesit shëndetësor mund t'ju monitorojë në video gjatë një EEG për të zbuluar dhe regjistruar çdo krizë që përjetoni. Kjo mund të bëhet kur jeni zgjuar ose në gjumë. Regjistrimi i krizave mund të ndihmojë në përcaktimin e llojit të krizave që keni ose të përjashtojë sëmundjet e tjera.
- EEG me densitet të lartë. Në një variant të një testi EEG, mund të keni një EEG me densitet të lartë, i cili i vendos elektrodat më afër sesa EEG-ja konvencionale. EEG me densitet të lartë mund të ndihmojë në përcaktimin më të saktë se cilat zona të trurit tuaj preken nga krizat.
- Tomografia e kompjuterizuar (CT) e trurit. Një skanim CT përdor rrezet X për të marrë imazhe tërthore të trurit tuaj. Skanimet CT mund të zbulojnë tumore, gjakderdhje ose ciste në tru që mund të shkaktojnë epilepsi.
- Rezonanca magnetike (MRI) e trurit. Një MRI përdor magnet të fuqishëm dhe valë radio për të krijuar një pamje të detajuar të trurit. Ashtu si një skanim CT, një MRI shikon strukturën e trurit për të zbuluar se çfarë mund të shkaktojë kriza epileptike. Po ashtu, një MRI ofron një vështrim më të detajuar të trurit sesa një skanim CT.
- Rezonanca magnetike funksionale (fMRI). Një MRI funksionale matë ndryshimet në rrjedhën e gjakut që ndodhin kur pjesë të veçanta të trurit janë duke punuar. Ky test mund të përdoret para operacionit për të identifikuar vendndodhjet e sakta të funksioneve kritike, të tilla si të folurit dhe lëvizjet, në mënyrë që kirurgët të shmangin dëmtimin e atyre vendeve gjatë operacionit.
- Tomografia me emetim pozitron (PET). Skanimet PET përdorin një sasi të vogël të materialit radioaktiv me dozë të ulët që injektohet në një venë për të ndihmuar në vizualizimin e aktivitetit metabolik të trurit dhe zbulimin e ndryshimeve. Zonat e trurit me metabolizëm të ulët mund të tregojnë vendet ku ndodhin krizat.
- Tomografia e kompjuterizuar me emetim me një foton (SPECT). Ky lloj testi përdoret kryesisht nëse MRI dhe EEG nuk kanë përcaktuar me saktësi vendndodhjen në tru ku kanë origjinën krizat. Një test SPECT përdor një sasi të vogël të materialit radioaktiv me dozë të ulët që injektohet në një venë për të krijuar një hartë të detajuar 3D të aktivitetit të rrjedhës së gjakut në tru gjatë krizave epileptike. Zonat me rrjedhje gjaku më të lartë se zakonisht gjatë një krize epileptike mund të tregojnë për lokalizimin. Një lloj tjetër i testit SPECT i quajtur SPECT iktal zbritës i bashkëregjistruar në MRI (SISCOM) mund të japë rezultate edhe më të detajuara duke mbivendosur rezultatet e SPECT me rezultatet e MRI të trurit.
- Testet neuropsikologjike. Këto teste vlerësojnë aftësitë e të menduarit, kujtesës dhe të folurit. Rezultatet e testit ndihmojnë në përcaktimin se cilat zona të trurit janë prekur nga krizat epileptike.
Së bashku me rezultatet e testit tuaj, një kombinim i teknikave të analizës mund të përdoret për të ndihmuar në përcaktimin se ku fillojnë krizat epileptike:
- Harta parametrike statistikore (SPM). SPM është një metodë e krahasimit të zonave të trurit që kanë rritur rrjedhjen e gjakut gjatë krizave me të njëjtat zona të trurit të njerëzve që nuk kanë kriza. Kjo jep informacion se ku fillojnë krizat epileptike.
- Imazhi i burimit elektrik (ESI). ESI është një teknikë që merr të dhënat EEG dhe i projekton ato në një MRI të trurit për të treguar zonat ku ndodhin krizat. Kjo teknikë ofron detaje më të sakta sesa vetëm EEG.
- Magnetoencefalografia (MEG). MEG mat fushat magnetike të prodhuara nga aktiviteti i trurit. Kjo ndihmon në identifikimin e zonave të mundshme ku fillojnë krizat. MEG mund të jetë më i saktë se EEG sepse kafka dhe indet që rrethojnë trurin ndërhyjnë më pak me fushat magnetike sesa me impulset elektrike. MEG dhe MRI së bashku ofrojnë imazhe që tregojnë zona të trurit të prekura nga krizat dhe jo të prekura nga krizat.
DIAGNOZA DIFERENCIALE
Jo të gjitha krizat e vetëdijes janë kriza të natyrës epileptike. Çrregullimet e tjera që duhet të merren parasysh para diagnostikimit të pacientëve me epilepsi janë:
- Sinkopa (p.sh., aritmi kardiake, sinkopë vazovagale)
- Çrregullimet metabolike (p.sh., hipoglikemia, hiponatremia)
- Migrena (p.sh., aura migrenoze)
- Çrregullimet vaskulare (p.sh. ataku iskemik tranzitor)
- Çrregullime të gjumit (p.sh., katapleksi, narkolepsia)
- Çrregullime të lëvizjes (p.sh., diskinezia paroksizmale)
- Çrregullime gastrointestinale (p.sh., refluksi ezofageal tek të sapolindurit dhe foshnjat)
- Çrregullimet psikiatrike (p.sh., çrregullimet konverzive, ataqet e panikut)
TRAJTIMI DHE PROGNOZA
Trajtimi mund të ndihmojë njerëzit e diagnostikuar me epilepsi të kenë më pak krizat ose madje të ndalojnë plotësisht krizat epileptike. Trajtimet e mundshme përfshijnë:
- Terapia antiepileptike
- Kirurgjia
- Pajisjet stimuluese të trurit
- Dieta ketogjene
Terapia antiepileptike:
Qëllimi i trajtimit te pacientët me epilepsi është arritja e një gjendje pa kriza epileptike dhe pa efekte anësore nga terapia. Ky synim realizohet në më shumë se 50% të pacientëve që kërkojnë trajtim me terapi antiepileptike. Zgjedhja e medikamentit për të trajtim të epilepsisë varet nga lloji i krizës epileptike, lloji i sindromës epileptike, etiologjia, toleranca dhe ndryshimet në EEG. Monoterapia është e dëshirueshme sepse zvogëlon gjasat e efekteve anësore dhe shmang ndërveprimet mes medikamenteve. Megjithatë, shumë pacientë përjetojnë efekte të padëshiruara dhe disa pacientë pësojnë kriza epileptike që janë refraktare ndaj terapisë.
Disa medikamente antiepileptike (p.sh., lamotrigina, topiramati, acidi valproik, zonisamidi) kanë mekanizma të shumëfishtë veprimi, dhe disa (p.sh., fenitoina, karbamazepina, etosuksimidi) kanë vetëm një mekanizëm veprimi të njohur. Ato mund të ndahen në grupe të mëdha në bazë të mekanizmave të tyre, si më poshtë:
- Bllokuesit e aktivizimit të përsëritur të kanalit të natriumit: fenitoina, karbamazepina, okskarbazepina, eslikarbazepina, lamotrigina, topiramati, cenobamati.
- Përmirësuesit e inaktivizimit të ngadaltë të kanalit të natriumit: lakosamidi, rufinamidi.
- Acidi gama-aminobutirik (GABA) – përmirësuesit e receptorit A: fenobarbitali, benzodiazepina, klobazami, ganaksoloni.
- Bllokuesit e receptorit N-metil-D-aspartik (NMDA): felbamati.
- Bllokuesit e receptorit të acidit propionik alfa-amino-3-hidroksi-5-metil-4-izoksazol (AMPA): perampaneli, topiramati.
- Bllokuesit e kanalit T-kalcium: etosuksimidi, valproati.
- Bllokuesit e kanaleve N- dhe L-kalciumi: lamotrigina, topiramati, zonisamidi, valproati.
- Modulatorët e rrymës H: gabapentini, lamotrigina.
- Bllokuesit e vendeve unike të lidhjes: gabapentina, levetiracetami, perampaneli.
- Inhibuesit e anhidrazës karbonike: topiramati, zonisamidi.
- Hapësi i kanalit neuronal të kaliumit (KCNQ [Kv7]): ezogabini.
- Antiepileptikët e tjerë: kanabidioli, stiripentoli, fenfluramina.
Këto barna mund të shkaktojnë disa efekte anësore. Efektet anësore të lehta përfshijnë:
- Lodhje
- Marramendje
- Shtim në peshë
- Humbja e densitetit kockor
- Skuqje e lëkurës
- Humbje e koordinimit
- Probleme të të folurit
- Probleme me kujtesën dhe të menduarit
Efektet anësore më të rënda, por të rralla përfshijnë:
- Depresioni
- Mendimet dhe sjelljet suicidale
- Sindroma Steven-Johnson
- Inflamacion i organeve të caktuara, siç është mëlçia
Kirurgjia e epilepsisë
Kur medikamentet antiepileptike nuk ofrojnë kontroll adekuat të krizave, intervenimi kirurgjik mund të konsiderohet si alternative për trajtim. Gjatë intervenimit kirurgjik të epilepsisë, një kirurg heq zonën e trurit që shkakton kriza.
Kirurgjia zakonisht ndodh kur testet tregojnë se:
- Krizat tuaja e kanë origjinën në një zonë e vogël dhe mirë e përcaktuar e trurit tuaj.
- Zona në trurin tuaj që do të operohet nuk ndërhyn në funksionet jetësore si të folurit, funksioni motorik, shikimi ose dëgjimi.
Për disa lloje të epilepsisë, qasjet minimalisht invazive si ablacioni me lazer stereotaktik i udhëhequr nga MRI mund të ofrojnë trajtim efektiv në rastet kur një intervenim kirurgjik i hapur mund të jetë shumë i rrezikshëm. Në këto procedura, një sondë termike lazer drejtohet në zonën specifike në tru për të shkatërruar atë ind në një përpjekje për të kontrolluar më mirë krizat epileptike. Edhe pse pacientët mund të vazhdojnë të kenë nevojë për disa medikamente antiepileptike, ata do të jenë në gjendje të marrin doza të reduktuara. Në një numër të vogël njerëzish intervenimi kirurgjik për epilepsi mund të shkaktojë komplikime të tilla si ndryshimi i përhershëm i aftësive të të menduarit.
Përveç medikamenteve antiepileptike dhe kirurgjisë, këto terapi të mundshme ofrojnë një alternativë për trajtimin e epilepsisë:
- Stimulimi i nervit vagus. Stimulimi i nervit vagus mund të jetë një opsion kur medikamentet antiepiletike nuk kanë funksionuar mjaftueshëm për të kontrolluar krizat epileptike dhe intervenimi kirurgjik nuk është i mundur. Në stimulimin e nervit vagus, një pajisje implantohet nën lëkurën e gjoksit dhe telat nga stimuluesi janë të lidhura me nervin vagus në qafë. Pajisja me bateri dërgon shpërthime të energjisë elektrike përmes nervit vagus në tru. Nuk është e qartë se si kjo i parandalon krizat epileptike, por pajisja zakonisht mund të reduktojë ato nga 20% në 40%. Shumica e njerëzve ende duhet të marrin medikamente antiepileptike, megjithëse disa njerëz mund të jenë në gjendje të ulin dozën e medikamenteve të tyre. Efektet anësore të stimulimit të nervit vagus mund të përfshijnë dhimbje në fyt, zë të ngjirur, gulçim ose kollë.
- Stimulimi i thellë i trurit. Në stimulimin e thellë të trurit, kirurgët implantojnë elektroda në një pjesë specifike të trurit, zakonisht në talamus. Elektrodat janë të lidhura me një gjenerator të implantuar në gjoks. Gjeneratori dërgon rregullisht impulse elektrike në tru në intervale të caktuara dhe mund të reduktojë krizat epileptike. Stimulimi i thellë i trurit përdoret shpesh për njerëzit, krizat e të cilëve nuk parandalohen me medikamente antiepileptike.
- Neurostimulimi responsiv. Këto pajisje të implantueshme mund të ndihmojnë në reduktimin e ndjeshëm të shpeshtësisë së krizave epileptike. Këto pajisje stimuluese reaguese analizojnë modelet e aktivitetit të trurit për të zbuluar krizat kur ato fillojnë dhe japin një ngarkesë elektrike ose medikament për të ndaluar krizat përpara se të shkaktojnë dëmtim. Hulumtimet tregojnë se kjo terapi ka pak efekte anësore dhe mund të sigurojë lehtësim afatgjatë të krizave epileptike.
- Dieta ketogjenike. Disa fëmijë dhe të rritur me epilepsi kanë qenë në gjendje të reduktojnë krizat e tyre duke ndjekur një dietë të rreptë që është e lartë në yndyrna dhe e ulët në karbohidrate. Dieta ketogjenike është një opsion kur medikamentet antiepileptike nuk ndihmojnë për të kontrolluar epilepsinë. Në këtë dietë, të quajtur dietë ketogjenike, trupi zbërthen yndyrnat në vend të karbohidrateve për energji. Pas disa vitesh, disa fëmijë mund të jenë në gjendje të ndalojnë dietën ketogjenike nën mbikëqyrjen e ngushtë të ofruesve të kujdesit shëndetësor dhe të jenë të lire nga krizat epileptike. Efektet anësore të një diete ketogjenike mund të përfshijnë dehidratim, konstipacionin, ngadalësim të rritjes për shkak të mangësive ushqyese dhe një grumbullim të acidit urik në gjak, i cili mund të shkaktojë gurë në veshka. Këto efekte anësore janë të rralla nëse dieta mbikëqyret siç duhet. Sidoqoftë, mbajtja e një diete ketogjenike mund të jetë një sfidë. Dieta me indeks të ulët glicemik dhe dietat e modifikuara Atkins ofrojnë alternativa më pak kufizuese që mund të ofrojnë ende disa përfitime për kontrollin e krizave epileptike.
Trajtime të mundshme në të ardhmen
Studiuesit po studiojnë shumë trajtime të reja të mundshme për epilepsinë, duke përfshirë:
- Stimulimi i vazhdueshëm i zonës së fillimit të krizave epileptike, i njohur si stimulim nën prag. Stimulimi i nënpragut - stimulimi i vazhdueshëm në një zonë të trurit nën një nivel që është fizikisht i dukshëm - duket se përmirëson cilësinë e jetës për disa njerëz me epilepsi. Stimulimi i nënpragut ndihmon në ndalimin e një krize epileptike përpara se të ndodhë. Kjo qasje trajtimi mund të funksionojë te njerëzit që kanë krizat që fillojnë në një zonë të trurit të quajtur zona elokuente, që nuk mund të hiqet sepse do të ndikonte në të folur dhe funksionet motorike. Ose mund të përfitojë njerëzit, karakteristikat e krizave të cilëve nënkuptojnë se shanset e tyre për trajtim të suksesshëm me neurostimulim reagues janë të ulëta.
- Kirurgji minimalisht invazive. Teknikat e reja kirurgjikale minimalisht invazive, të tilla si ultratingulli i fokusuar i drejtuar nga MRI, janë treguar premtuese për trajtimin e krizave. Këto intervenime kirurgjike kanë më pak rreziqe sesa intervenimet tradicionale për epilepsinë
- në trurit e hapur.
- Stimulimi magnetik transkranial (TMS). TMS aplikon fusha magnetike të fokusuara në zonat e trurit ku ndodhin krizat epileptike për të trajtuar krizat pa pasur nevojë për kirurgji. Mund të përdoret për pacientët krizat e të cilëve ndodhin afër sipërfaqes së trurit dhe nuk mund të trajtohen me kirurgji.
- Stimulimi i jashtëm i nervit trigeminal. Ngjashëm me stimulimin e nervit vagus, një pajisje stimulon nervin trigeminal për të zvogëluar shpeshtësinë e krizave epileptike. Por ndryshe nga stimulimi i nervit vagus, pajisja vishet jashtë trupit, kështu që nuk nevojitet asnjë intervenim kirurgjik për ta vendosur pajisjen në trup. Në studime e fundit, stimulimi i jashtëm i nervit trigeminal ofroi përmirësime si në kontrollin e krizave epileptike, ashtu edhe në disponimin.
REFERENCAT:
1. Mayo Clinic – Epilepsy https://www.mayoclinic.org/diseases-conditions
2. NHS – Epilepsy https://www.nhs.uk/conditions/
3. Medscape – Epilepsy https://emedicine.medscape.com/
4. 2017 ILAE Classification of Epilepsies https://www.ilae.org/guidelines/definition-andclassification/ilae-classification-of-the-epilepsies-2017
Përgatiti: Ass. Dr. Esra Zhubi
Redaktoi: Ass. Dr. Blerim Myftiu
Përditësuar: Gusht 2024
